
9.7: Orbitales moleculares
- ID de página
- 21757
Ninguno de los enfoques que hemos descrito hasta ahora puede explicar adecuadamente por qué algunos compuestos están coloreados y otros no, por qué algunas sustancias con electrones no apareados son estables y por qué otros son semiconductores efectivos. Estos enfoques tampoco pueden describir la naturaleza de la resonancia. Dichas limitaciones llevaron al desarrollo de un nuevo enfoque para la unión en el cual los electrones son vistos como localizados entre los núcleos de los átomos unidos, sino que son deslocalizados La molécula entera. Al igual que con la teoría del enlace de valencia, el enfoque que estamos a punto de discutir se basa en un modelo de mecánica cuántica.
Anteriormente, describimos que los electrones en átomos aislados tenían ciertas distribuciones espaciales, llamadas orbitales , cada una con una energía orbital particular . Así como las posiciones y energías de los electrones en átomos pueden describirse en términos de orbitales atómicos (AOs), las posiciones y energías de los electrones en moléculas pueden ser descrito en términos de orbitales moleculares (MO) Una distribución espacial particular de electrones en una molécula que está asociada con una energía orbital particular. —una distribución espacial de electrones en una molécula que está asociada con una energía orbital particular. Como su nombre indica, los orbitales moleculares no están localizados en un solo átomo, sino que se extienden por toda la molécula. En consecuencia, el enfoque orbital molecular, llamado teoría orbital molecular es un enfoque deslocalizado para la unión.
Teoría de la órbita molecular: un enfoque de enlace deslocalizado
Aunque la teoría de los orbitales moleculares es computacionalmente exigente, los principios en los que se basa son similares a los que usamos para determinar las configuraciones electrónicas de los átomos. La diferencia clave es que en los orbitales moleculares, los electrones pueden interactuar con más de un núcleo atómico a la vez. Al igual que con los orbitales atómicos, creamos un diagrama de nivel de energía enumerando los orbitales moleculares en orden de aumento de energía. Luego llenamos los orbitales con el número requerido de electrones de valencia de acuerdo con el principio de Pauli. Esto significa que cada orbital molecular puede acomodar un máximo de dos electrones con espines opuestos.
Orbitales moleculares que involucran solo ns Orbitales atómicos
Comenzamos nuestra discusión de los orbitales moleculares con la molécula más simple, H 2 , formada por dos átomos de hidrógeno aislados, cada uno con un 1 s 1 electrón configuración. Como explicamos en el Capítulo 9, los electrones pueden comportarse como ondas. En el enfoque orbital molecular, los orbitales atómicos superpuestos se describen mediante ecuaciones matemáticas llamadas funciones de onda . Los orbitales atómicos 1 s en los dos átomos de hidrógeno interactúan para formar dos nuevos orbitales moleculares, uno producido al tomar la suma de las dos funciones de onda H 1 s , y el otro producido tomando su diferencia :
[ begin {matrix}
MO (1) = & AO (átomo ; A) & + & AO (átomoB) \
MO (1) = & AO (átomo ; A) & – & AO (átomoB)
end {matrix} label {9.7.1} ]
Los orbitales moleculares creados a partir de la ecuación ( ref {9.7.1} ) se denominan combinaciones lineales de orbitales atómicos (LCAO) Orbitales moleculares creados a partir de la suma y la diferencia de dos funciones de onda ( orbitales atómicos) . Una molécula debe tener tantos orbitales moleculares como orbitales atómicos.
Una molécula debe tener tantos orbitales moleculares como orbitales atómicos.
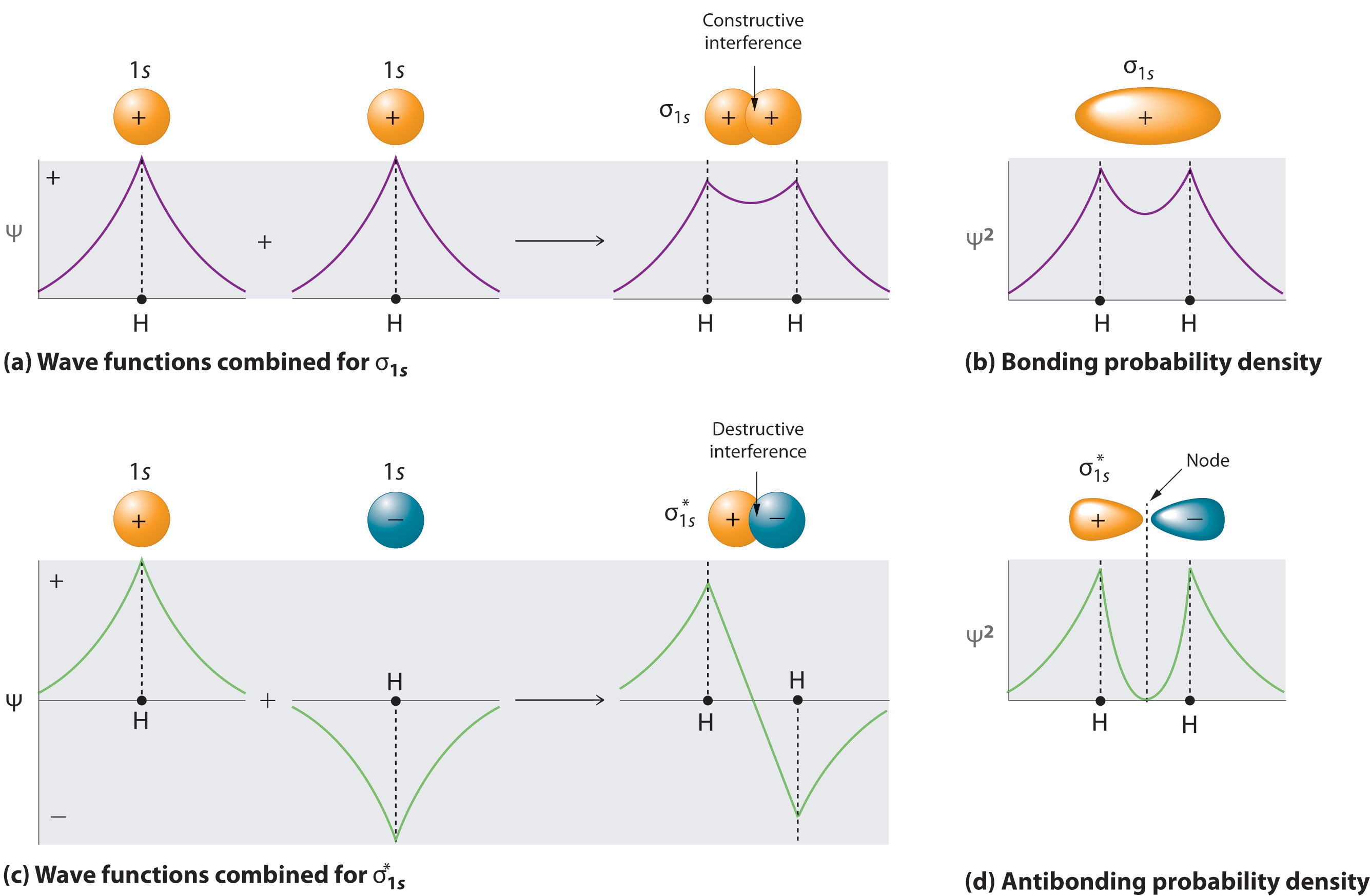
Agregar dos orbitales atómicos corresponde a interferencia constructiva entre dos ondas, reforzando así su intensidad; la densidad de probabilidad de electrones internucleares es aumentada . El orbital molecular correspondiente a la suma de los dos orbitales H 1 s se llama σ 1 s combinación (pronunciado “sigma one” ess ”) (parte (a) y parte (b) en la Figura ( PageIndex {1} )). En un orbital sigma (σ), (es decir, un orbital molecular de enlace en el que la densidad electrónica a lo largo del eje internuclear y entre los núcleos tiene simetría cilíndrica ), la densidad electrónica a lo largo del eje internuclear y entre los núcleos tiene simetría cilíndrica; es decir, todas las secciones transversales perpendiculares al eje internuclear son círculos. El subíndice 1 s denota los orbitales atómicos de los cuales se deriva el orbital molecular: El signo is se usa en lugar de un signo = porque estamos ignorando ciertas constantes que no son importantes para nuestro argumento.
[ sigma _ {1s} aprox 1s left (A right) + 1s left (B right) label {9.7.2} ]
Por el contrario, restar un orbital atómico de otro corresponde a interferencia destructiva entre dos ondas, lo que reduce su intensidad y provoca una disminución en la densidad de probabilidad de electrones internucleares (parte (c) y la parte (d) en la Figura ( PageIndex {1} )). El patrón resultante contiene un nodo donde la densidad de electrones es cero. El orbital molecular correspondiente a la diferencia se llama ( sigma _ {1s} ^ {*} ) (“sigma one ess star”). En un orbital sigma star (σ *) Un orbital molecular antienvejecimiento en el que hay una región de probabilidad de electrones cero (un plano nodal) perpendicular al eje internuclear. , hay una región de probabilidad de electrones cero, un plano nodal, perpendicular al eje internuclear:
[ sigma _ {1s} ^ { star} aprox 1s left (A right) – 1s left (B right) label {9.7.3} ]
La densidad de electrones en el σ 1 s orbital molecular es mayor entre los dos núcleos cargados positivamente, y las atracciones electrostáticas resultantes electrón-núcleo reducen las repulsiones entre los núcleos Así, el orbital σ 1 s representa un orbital molecular de unión . Un orbital molecular que se forma cuando los orbitales atómicos o los lóbulos orbitales con el mismo signo interactúan para aumentar la probabilidad de electrones entre los núcleos debido al refuerzo constructivo de las funciones de onda . En contraste, los electrones en el orbital ( sigma _ {1s} ^ { star} ) generalmente se encuentran en el espacio fuera de la región internuclear. Debido a que esto permite que los núcleos cargados positivamente se repelen entre sí, el orbital ( sigma _ {1s} ^ { star} ) es un orbital molecular antienlazante (un orbital molecular que se forma cuando orbitales atómicos o los lóbulos orbitales de signo opuesto interactúan para dar una probabilidad reducida de electrones entre los núcleos debido al refuerzo destructivo de las funciones de onda) .
Los orbitales antibonding contienen un nodo perpendicular al eje internuclear; orbitales de unión no lo hacen.
Diagramas de nivel de energía
Debido a que los electrones en el orbital σ 1 s interactúan simultáneamente con ambos núcleos, tienen una energía menor que los electrones que interactúan con un solo núcleo. Esto significa que el σ 1 s tiene una energía menor que cualquiera del hidrógeno 1 s orbitales atómicos. Por el contrario, los electrones en el orbital ( sigma _ {1s} ^ { star} ) interactúan con un solo núcleo de hidrógeno a la vez. Además, están más lejos del núcleo de lo que estaban en los orbitales atómicos del hidrógeno padre 1 s . En consecuencia, el orbital molecular ( sigma _ {1s} ^ { star} ) tiene una energía más alta que cualquiera de los átomos de hidrógeno 1 s orbitales El σ 1 s (enlace) es el estabilizado en relación con el 1 s y orbitales atómicos, El orbital molecular ( sigma _ {1s} ^ { star} ) (antibonding) está desestabilizado . Los niveles de energía relativos de estos orbitales se muestran en el diagrama de nivel de energía (un dibujo esquemático que compara las energías de los orbitales moleculares (unión, antibondición, y no unión) con las energías de los orbitales atómicos principales) en la Figura ( PageIndex {2} )
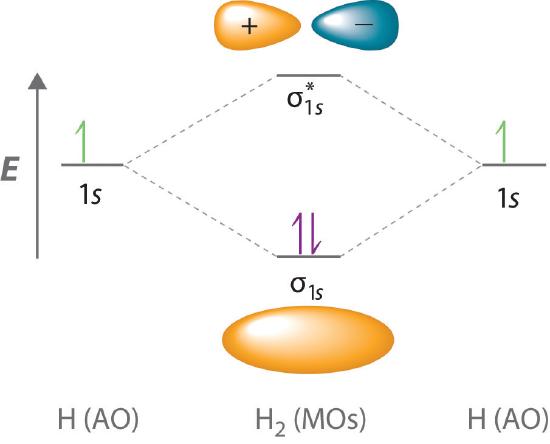
Un orbital molecular de enlace es siempre más bajo en energía (más estable) que los orbitales atómicos componentes, mientras que un orbital molecular antienvejecimiento es siempre más alto en energía (menos estable).
Para describir la unión en una molécula diatómica homonuclear (una molécula que consta de dos átomos del mismo elemento) como H 2 , utilizamos orbitales moleculares; es decir, para una molécula en la que dos átomos idénticos interactúan, insertamos el número total de electrones de valencia en el diagrama de nivel de energía (Figura ( PageIndex {2} )). Llenamos los orbitales de acuerdo con el principio de Pauli y la regla de Hund : cada orbital puede acomodar un máximo de dos electrones con espines opuestos, y los orbitales se llenan en orden creciente de energía. Debido a que cada átomo de H contribuye con un electrón de valencia, los dos electrones resultantes son exactamente suficientes para llenar el orbital molecular de enlace σ 1 s . Los dos electrones entran en un orbital cuya energía es más baja que la de los orbitales atómicos principales, por lo que la molécula H 2 es más estable que los dos átomos de hidrógeno aislados. Por lo tanto, la teoría de la órbita molecular predice correctamente que H 2 es una molécula estable. Debido a que los enlaces se forman cuando los electrones se concentran en el espacio entre los núcleos, este enfoque también es consistente con nuestra discusión anterior sobre los enlaces de pares de electrones.
Orden de enlace en la teoría de la órbita molecular
En las estructuras de electrones de Lewis, el número de pares de electrones que mantienen dos átomos juntos se llamó el orden de enlace . En el enfoque orbital molecular, orden de enlace La mitad del número neto de electrones de enlace en una molécula. se define como la mitad del número neto de electrones de enlace:
[enlace ; orden = dfrac {número ; de ; unión ; número de electrones ; de ; antibonding ; electrones} {2} label {9.7.4} ]
Para calcular el orden de enlace de H 2 , vemos en la Figura ( PageIndex {2} ) que σ 1 s [19459176 ] (enlace) el orbital molecular contiene dos electrones, mientras que el orbital molecular ( sigma _ {1s} ^ { star} ) (antiadherente) está vacío. El orden de enlace de H 2 es, por lo tanto,
[ dfrac {2-0} {2} = 1 label {9.7.5} ]
Este resultado corresponde al enlace covalente único predicho por los símbolos de puntos de Lewis. Por lo tanto, la teoría de la órbita molecular y el enfoque del par de electrones de Lewis coinciden en que un enlace simple que contiene dos electrones tiene un orden de enlace de 1. Los enlaces dobles y triples contienen cuatro o seis electrones, respectivamente, y corresponden a los órdenes de enlace de 2 y 3. Podemos use diagramas de nivel de energía como el de la Figura ( PageIndex {2} ) para describir el enlace en otros pares de átomos e iones donde n = 1, como el H 2 + ion, la molécula He 2 + , y la molécula He 2 . Nuevamente, primero llenamos los orbitales moleculares de menor energía mientras nos aseguramos de no violar el principio de Pauli o la regla de Hund .
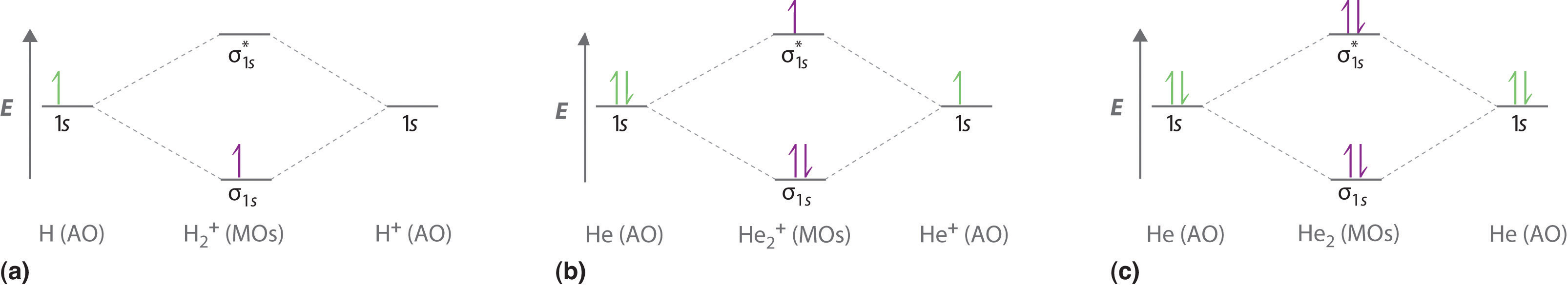
La figura ( PageIndex {3a} ) muestra el diagrama de nivel de energía para el ion H 2 + , que contiene dos protones y un solo electrón. El electrón individual ocupa el σ 1 s enlace orbital molecular, dando un (σ 1 s s s s ] ) 1 configuración electrónica. El número de electrones en un orbital se indica mediante un superíndice. En este caso, el orden de los bonos es
[ dfrac {1-0} {2} = 1/2 ]
Debido a que el orden de enlace es mayor que cero, el ion H 2 + debería ser más estable que un átomo de H aislado y un protón. Por lo tanto, podemos usar un diagrama de nivel de energía orbital molecular y el orden de enlace calculado para predecir la estabilidad relativa de especies como H 2 + . Con un orden de enlace de solo 1/2, el enlace en H 2 + debería ser más débil que en la molécula H 2 , y el enlace H – H debería ser más largo Como se muestra en la Tabla ( PageIndex {1} ), estas predicciones concuerdan con los datos experimentales.
La figura ( PageIndex {3b} ) es el diagrama de nivel de energía orbital molecular para He 2 + . Este ion tiene un total de tres electrones de valencia. Debido a que los dos primeros electrones llenan por completo el σ 1 s orbital molecular, el principio de Pauli establece que el tercer electrón debe estar en el ( sigma _ { 1s} ^ { star} ) orbital antibonding, dando un ( left ( sigma _ {1s} right) ^ {2} left ( sigma _ {1s} ^ { star} right) ^ {1} ) configuración electrónica. Esta configuración electrónica da un orden de enlace de
[ dfrac {2-1} {2} = 1/2 ]
Al igual que con H 2 + , el ion He 2 + debe ser estable, pero el enlace He – He debe ser estable más débil y más largo que en H 2 . De hecho, el ión He 2 + puede prepararse y sus propiedades son consistentes con nuestras predicciones (Tabla ( PageIndex {1} )).
| Molécula o ión | Configuración electrónica | Orden de fianza | Longitud de enlace (pm) | Energía de enlace (kJ / mol) |
|---|---|---|---|---|
| H 2 + | (σ 1 s ) 1 | 1/2 | 106 | 269 |
| H 2 | (σ 1 s ) 2 | 1 | 74 | 436 |
| Él 2 + | ( left ( sigma _ {1s} right) ^ {2} left ( sigma _ {1s} ^ { star} right) ^ {1} ) | 1/2 | 108 | 251 |
| Él 2 | ( left ( sigma _ {1s} right) ^ {2} left ( sigma _ {1s} ^ { star} right) ^ {2} ) | 0 | no observado | no observado |
Finalmente, examinamos la molécula He 2 , formada a partir de dos átomos de He con configuraciones de electrones 1 s 2 . La figura ( PageIndex {3c} ) es el diagrama de nivel de energía orbital molecular para He 2 . Con un total de cuatro electrones de valencia, tanto los σ 1 s unión como ( sigma _ {1s} ^ { star} ) antibonding orbitals debe contener dos electrones. Esto proporciona una configuración de electrones ( left ( sigma _ {1s} right) ^ {2} left ( sigma _ {1s} ^ { star} right) ^ {1} ), con una predicción orden de enlace de (2 – 2) ÷ 2 = 0, lo que indica que la molécula He 2 no tiene enlace neto y no es una especie estable. Los experimentos muestran que la molécula He 2 es en realidad menos estable que dos átomos de He aislados debido a desfavorables interacciones electrón-electrón y núcleo-núcleo.
En la teoría de los orbitales moleculares, los electrones en los orbitales antienvejecimiento cancelan efectivamente la estabilización resultante de los electrones en los orbitales de unión . En consecuencia, cualquier sistema que tenga el mismo número de electrones de enlace y antienlace tendrá un orden de enlace de 0, y se prevé que sea inestable y, por lo tanto, que no exista en la naturaleza. A diferencia de las estructuras de electrones de Lewis y el enfoque del enlace de valencia, la teoría de la órbita molecular es capaz de acomodar sistemas con un número impar de electrones, como el ion H 2 + .
A diferencia de las estructuras electrónicas de Lewis y el enfoque de enlace de valencia, la teoría de los orbitales moleculares puede acomodar sistemas con un número impar de electrones.
Hasta ahora, nuestra discusión sobre los orbitales moleculares se ha limitado a la interacción de los orbitales de valencia, que tienden a estar más alejados del núcleo. Cuando dos átomos están lo suficientemente cerca como para que sus orbitales de valencia se superpongan significativamente, las capas de electrones internas llenas están en gran parte sin perturbaciones; por lo tanto, no necesitan ser considerados en un esquema orbital molecular. Además, cuando los orbitales internos están completamente llenos, contienen exactamente suficientes electrones para llenar por completo tanto los orbitales moleculares de unión como de antienvejecimiento que surgen de su interacción. Por lo tanto, la interacción de los depósitos rellenos siempre da un orden de enlace de 0, por lo que los depósitos rellenos no son un factor al predecir la estabilidad de una especie. Esto significa que podemos centrar nuestra atención en los orbitales moleculares derivados de los orbitales atómicos de valencia.
Un diagrama orbital molecular que se puede aplicar a cualquier molécula diatómica homonuclear con dos átomos de metal alcalino idénticos (Li 2 y Cs 2 , por ejemplo) se muestra en la parte (a) en la Figura ( PageIndex {4} ), donde M representa el átomo de metal. Solo dos niveles de energía son importantes para describir los orbitales moleculares de electrones de valencia de estas especies: un σ ns uniendo el orbital molecular y un σ * [19459177 ] ns antienlace molecular orbital. Debido a que cada metal alcalino (M) tiene una configuración de electrones de valencia ns 1 , la molécula M 2 tiene dos electrones de valencia que llenan el σ ] ns enlace orbital. Como resultado, se predice un orden de enlace de 1 para todas las especies diatómicas homonucleares formadas a partir de los metales alcalinos (Li 2 , Na 2 , K 2 , Rb 2 y Cs 2 ). Las características generales de estos diagramas M 2 son idénticas al diagrama para la molécula H 2 en la Figura ( PageIndex {4} ). Experimentalmente, todos se encuentran estables en la fase gaseosa, y algunos incluso son estables en solución.
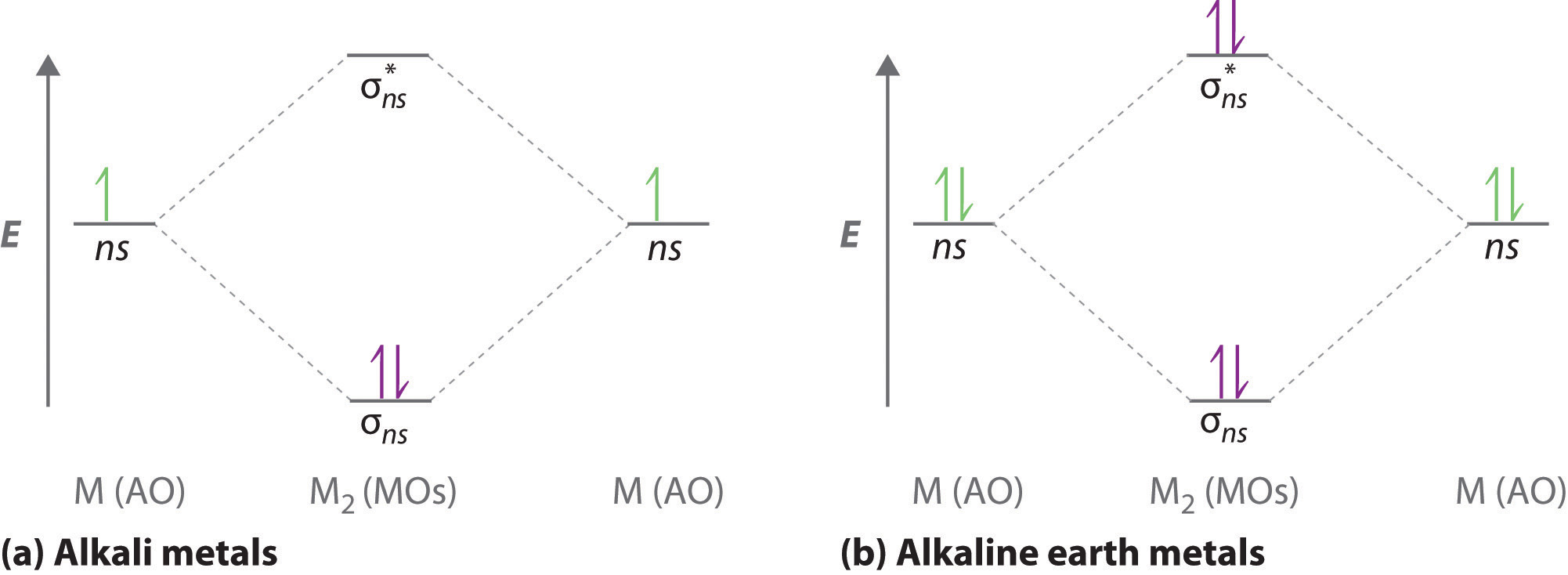
Del mismo modo, los diagramas orbitales moleculares para compuestos diatómicos homonucleares de los metales alcalinotérreos (como Be 2 ), en los que cada átomo metálico tiene un ns 2 [ 19459191] configuración electrónica de valencia, se asemeja al diagrama para la molécula He 2 en la parte (c) en la Figura ( PageIndex {2} ). Como se muestra en la parte (b) en la Figura ( PageIndex {4} ), este es el caso. Todas las moléculas diatómicas de tierra alcalina homonucleares tienen cuatro electrones de valencia, que llenan tanto el σ ns enlace orbital como el σ ns ] * antienlace orbital y dar un orden de enlace de 0. Así ser 2 , Mg 2 , Ca 2 , Sr 2 , and Ba 2 are all expected to be unstable, in agreement with experimental data. In the solid state, however, all the alkali metals and the alkaline earth metals exist as extended lattices held together by metallic bonding. At low temperatures, (Be_2) is st able.
Molecular Orbitals Formed from ns and np Atomic Orbitals
Atomic orbitals other than ns orbitals can also interact to form molecular orbitals. Because individual p , d , and f orbitals are not spherically symmetrical, however, we need to define a coordinate system so we know which lobes are interacting in three-dimensional space. Recall that for each np subshell, for example, there are np x , np y , and np z orbitals. All have the same energy and are therefore degenerate, but they have different spatial orientations.
[ sigma _{np_{z}}=np_{z}left ( A right )-np_{z}left ( B right ) label{9.7.6}]
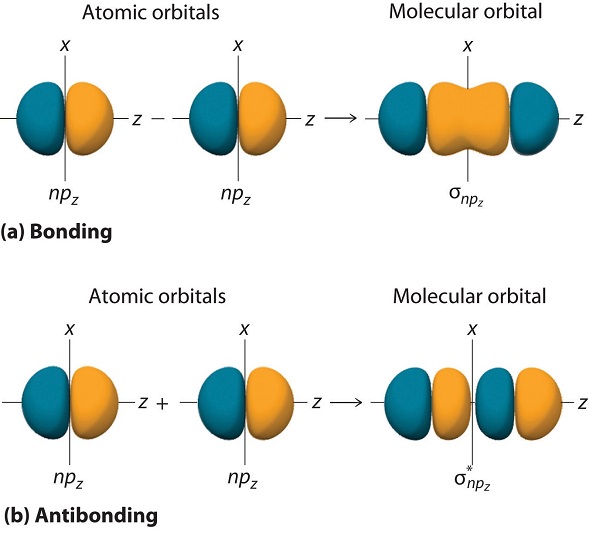
Just as with ns orbitals, we can form molecular orbitals from np orbitals by taking their mathematical sum and difference. When two positive lobes with the appropriate spatial orientation overlap, as illustrated for two np z atomic orbitals in part (a) in Figure (PageIndex{5}), it is the mathematical difference of their wave functions that results in constructive interference, which in turn increases the electron probability density between the two atoms. The difference therefore corresponds to a molecular orbital called a ( sigma _{np_{z}} ) bonding molecular orbital because, just as with the σ orbitals discussed previously, it is symmetrical about the internuclear axis (in this case, the z -axis):
[ sigma _{np_{z}}=np_{z}left ( A right )-np_{z}left ( B right ) label{9.7.7A}]
The other possible combination of the two np z orbitals is the mathematical sum:
[ sigma _{np_{z}}=np_{z}left ( A right )+np_{z}left ( B right ) label{9.7.7}]
In this combination, shown in part (b) in Figure (PageIndex{5}), the positive lobe of one np z atomic orbital overlaps the negative lobe of the other, leading to destructive interference of the two waves and creating a node between the two atoms. Hence this is an antibonding molecular orbital. Because it, too, is symmetrical about the internuclear axis, this molecular orbital is called a ( sigma _{np_{z}}=np_{z}left ( A right )-np_{z}left ( B right ) ) antibonding molecular orbital . Whenever orbitals combine, the bonding combination is always lower in energy (more stable) than the atomic orbitals from which it was derived, and the antibonding combination is higher in energy (less stable).
The remaining p orbitals on each of the two atoms, np x and np y , do not point directly toward each other. Instead, they are perpendicular to the internuclear axis. If we arbitrarily label the axes as shown in Figure (PageIndex{6}), we see that we have two pairs of np orbitals: the two np x orbitals lying in the plane of the page, and two np y orbitals perpendicular to the plane. Although these two pairs are equivalent in energy, the np x orbital on one atom can interact with only the np x orbital on the other, and the np y orbital on one atom can interact with only the np y on the other. These interactions are side-to-side rather than the head-to-head interactions characteristic of σ orbitals. Each pair of overlapping atomic orbitals again forms two molecular orbitals: one corresponds to the arithmetic sum of the two atomic orbitals and one to the difference. The sum of these side-to-side interactions increases the electron probability in the region above and below a line connecting the nuclei, so it is a bonding molecular orbital that is called a pi (π) orbital (a bonding molecular orbital formed from the side-to-side interactions of two or more parallel np atomic orbitals) . The difference results in the overlap of orbital lobes with opposite signs, which produces a nodal plane perpendicular to the internuclear axis; hence it is an antibonding molecular orbital, called a pi star (π*) orbital An antibonding molecular orbital formed from the difference of the side-to-side interactions of two or more parallel np atomic orbitals, creating a nodal plane perpendicular to the internuclear axis. .
[ pi _{np_{x}}=np_{x}left ( A right )+np_{x}left ( B right ) label{9.7.8}]
[ pi ^{star }_{np_{x}}=np_{x}left ( A right )-np_{x}left ( B right ) label{9.7.9}]
The two np y orbitals can also combine using side-to-side interactions to produce a bonding ( pi _{np_{y}} ) molecular orbital and an antibonding ( pi _{np_{y}}^{star } ) molecular orbital. Because the np x and np y atomic orbitals interact in the same way (side-to-side) and have the same energy, the ( pi _{np_{x}} ) and ( pi _{np_{y}} )molecular orbitals are a degenerate pair, as are the ( pi _{np_{x}}^{star } ) and ( pi _{np_{y}}^{star } ) molecular orbitals.
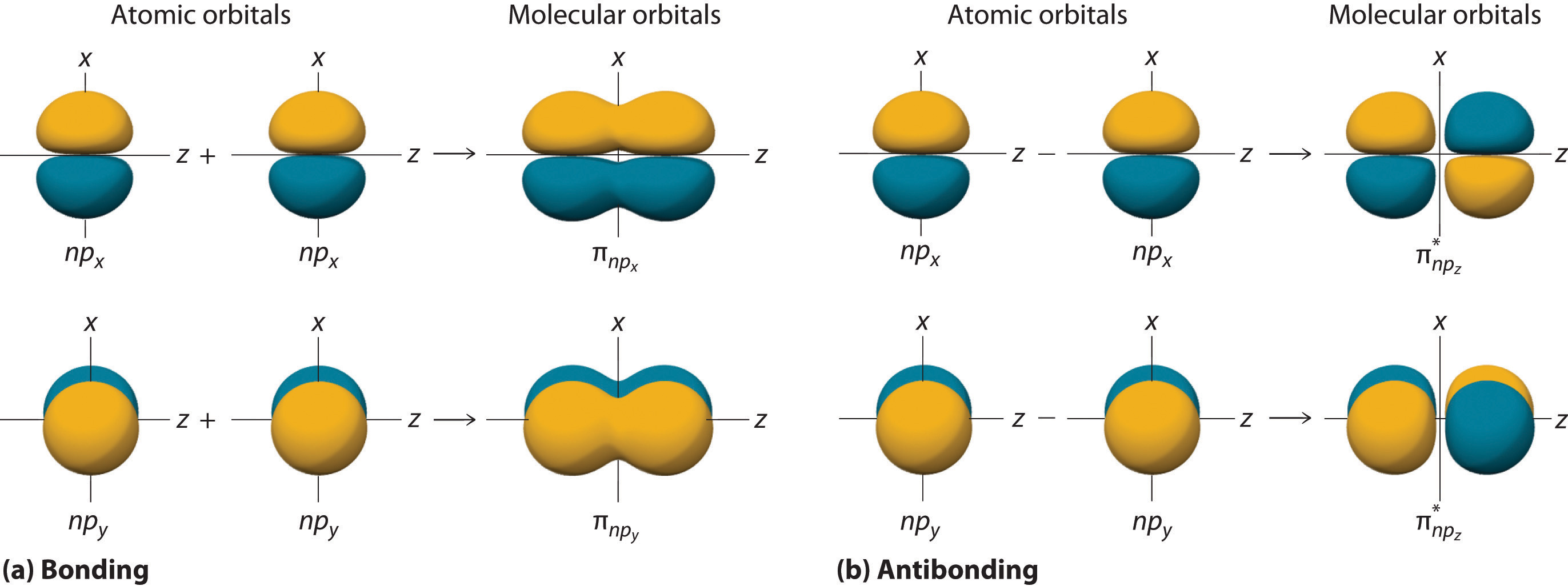
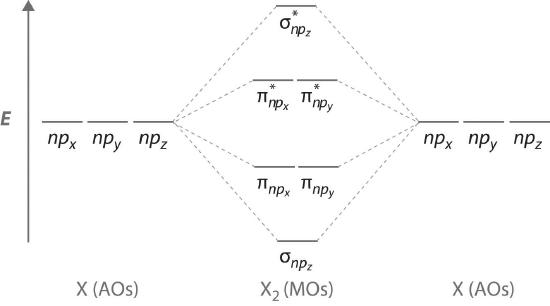
Figure (PageIndex{7}) is an energy-level diagram that can be applied to two identical interacting atoms that have three np atomic orbitals each. There are six degenerate p atomic orbitals (three from each atom) that combine to form six molecular orbitals, three bonding and three antibonding. The bonding molecular orbitals are lower in energy than the atomic orbitals because of the increased stability associated with the formation of a bond. Conversely, the antibonding molecular orbitals are higher in energy, as shown. The energy difference between the σ and σ* molecular orbitals is significantly greater than the difference between the two π and π* sets. The reason for this is that the atomic orbital overlap and thus the strength of the interaction are greater for a σ bond than a π bond, which means that the σ molecular orbital is more stable (lower in energy) than the π molecular orbitals.
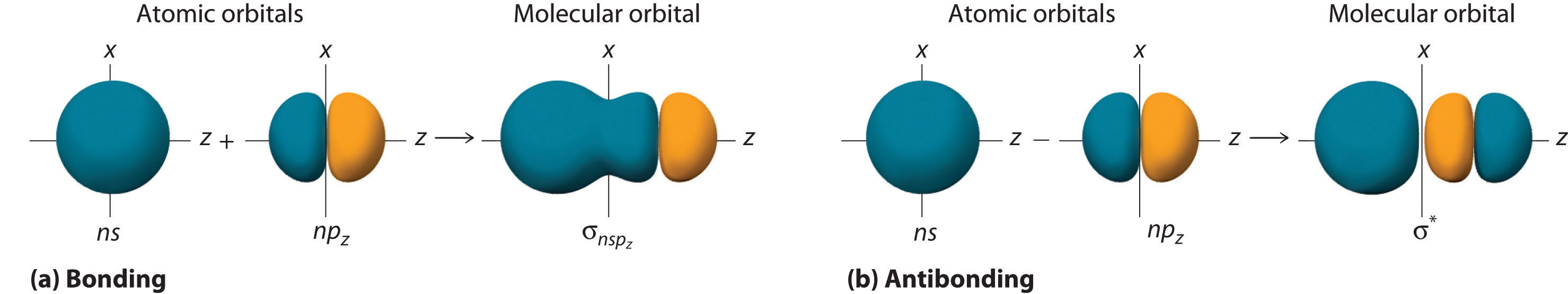
Although many combinations of atomic orbitals form molecular orbitals, we will discuss only one other interaction: an ns atomic orbital on one atom with an np z atomic orbital on another. As shown in Figure (PageIndex{8}), the sum of the two atomic wave functions ( ns + np z ) produces a σ bonding molecular orbital. Their difference ( ns − np z ) produces a σ* antibonding molecular orbital, which has a nodal plane of zero probability density perpendicular to the internuclear axis.
Summary
Molecular orbital theory, a delocalized approach to bonding, can often explain a compound’s color, why a compound with unpaired electrons is stable, semiconductor behavior, and resonance, none of which can be explained using a localized approach. A molecular orbital (MO) is an allowed spatial distribution of electrons in a molecule that is associated with a particular orbital energy. Unlike an atomic orbital (AO), which is centered on a single atom, a molecular orbital extends over all the atoms in a molecule or ion. Hence the molecular orbital theory of bonding is a delocalized approach. Molecular orbitals are constructed using linear combinations of atomic orbitals (LCAOs) , which are usually the mathematical sums and differences of wave functions that describe overlapping atomic orbitals. Atomic orbitals interact to form three types of molecular orbitals.
- Orbitals or orbital lobes with the same sign interact to give increased electron probability along the plane of the internuclear axis because of constructive reinforcement of the wave functions. Consequently, electrons in such molecular orbitals help to hold the positively charged nuclei together. Such orbitals are bonding molecular orbitals , and they are always lower in energy than the parent atomic orbitals.
- Orbitals or orbital lobes with opposite signs interact to give decreased electron probability density between the nuclei because of destructive interference of the wave functions. Consequently, electrons in such molecular orbitals are primarily located outside the internuclear region, leading to increased repulsions between the positively charged nuclei. These orbitals are called antibonding molecular orbitals , and they are always higher in energy than the parent atomic orbitals.
- Some atomic orbitals interact only very weakly, and the resulting molecular orbitals give essentially no change in the electron probability density between the nuclei. Hence electrons in such orbitals have no effect on the bonding in a molecule or ion. These orbitals are nonbonding molecular orbitals , and they have approximately the same energy as the parent atomic orbitals.
A completely bonding molecular orbital contains no nodes (regions of zero electron probability) perpendicular to the internuclear axis, whereas a completely antibonding molecular orbital contains at least one node perpendicular to the internuclear axis. A sigma (σ) orbital (bonding) or a sigma star (σ*) orbital (antibonding) is symmetrical about the internuclear axis. Hence all cross-sections perpendicular to that axis are circular. Both a pi (π) orbital (bonding) and a pi star (π*) orbital (antibonding) possess a nodal plane that contains the nuclei, with electron density localized on both sides of the plane.
The energies of the molecular orbitals versus those of the parent atomic orbitals can be shown schematically in an energy-level diagram . The electron configuration of a molecule is shown by placing the correct number of electrons in the appropriate energy-level diagram, starting with the lowest-energy orbital and obeying the Pauli principle; that is, placing only two electrons with opposite spin in each orbital. From the completed energy-level diagram, we can calculate the bond order , defined as one-half the net number of bonding electrons. In bond orders, electrons in antibonding molecular orbitals cancel electrons in bonding molecular orbitals, while electrons in nonbonding orbitals have no effect and are not counted. Bond orders of 1, 2, and 3 correspond to single, double, and triple bonds, respectively. Molecules with predicted bond orders of 0 are generally less stable than the isolated atoms and do not normally exist.
Contributors
-
Modified by Joshua Halpern ( Howard University )