Las estructuras de resonancia son un conjunto de dos o más estructuras de Lewis que describen colectivamente el enlace electrónico de una sola especie poliatómica que incluye enlaces fraccionales y cargas fraccionales. Las estructuras de resonancia son capaces de describir electrones deslocalizados que no pueden expresarse mediante una sola fórmula de Lewis con un número entero de enlaces covalentes.
A veces una estructura de Lewis no es suficiente
A veces, incluso cuando se consideran cargos formales , el enlace en algunas moléculas o iones no puede ser descrito por una sola estructura de Lewis. La resonancia es una forma de describir los electrones deslocalizados dentro de ciertas moléculas o iones poliatómicos donde el enlace no puede expresarse mediante una sola fórmula de Lewis. Una molécula o ion con tales electrones deslocalizados está representada por varias estructuras contribuyentes (también llamadas estructuras de resonancia o formas canónicas). Tal es el caso del ozono ( ( ce {O3} )), un alótropo de oxígeno con una estructura en forma de V y un ángulo O – O – O de 117.5 °.
Ozono ( (O_3 ))
1. Sabemos que el ozono tiene una estructura en forma de V, por lo que un átomo de O es central:

2. Cada átomo de O tiene 6 electrones de valencia, para un total de 18 electrones de valencia.
3. Asignando un par de electrones de enlace a cada enlace oxígeno-oxígeno da
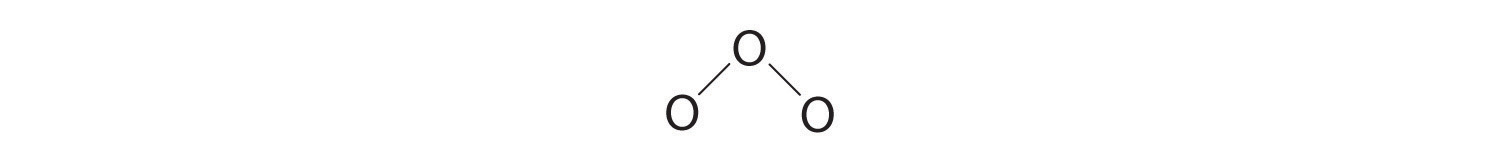
con 14 electrones sobrantes.
4. Si colocamos tres pares solitarios de electrones en cada oxígeno terminal, obtenemos

y les sobran 2 electrones.
5. En este punto, ambos átomos de oxígeno terminales tienen octetos de electrones. Por lo tanto, colocamos los últimos 2 electrones en el átomo central:
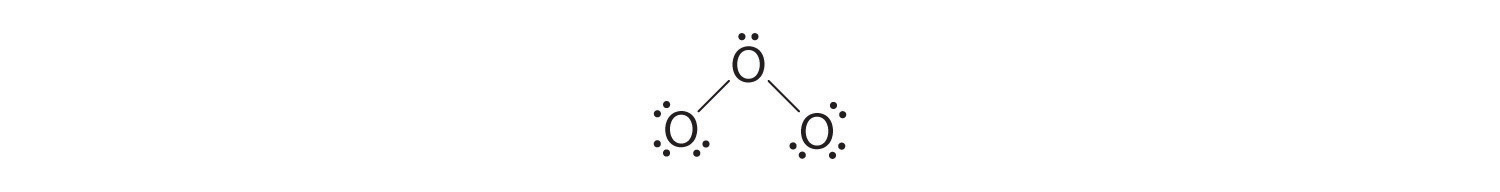
6. El oxígeno central tiene solo 6 electrones. Debemos convertir un par solitario en un átomo de oxígeno terminal en un par de electrones de enlace, pero ¿cuál? Dependiendo de cuál elijamos, obtenemos
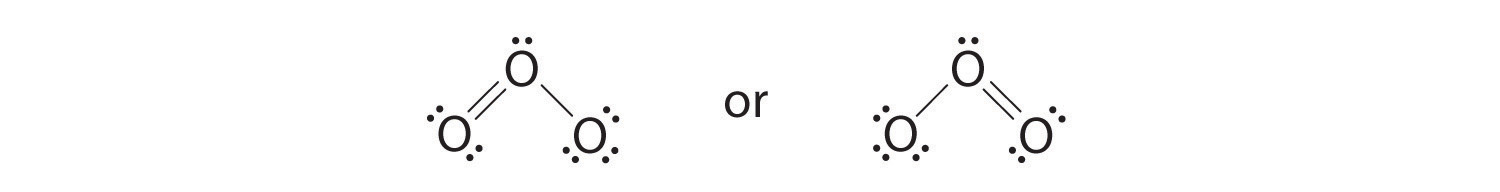
¿Cuál es correcto? De hecho, ninguno es correcto. Ambos predicen un enlace simple O – O y un enlace doble O = O. Como aprenderá, si los enlaces fueran de diferentes tipos (uno simple y uno doble, por ejemplo), tendrían diferentes longitudes. Sin embargo, resulta que ambas distancias de enlace O-O son idénticas, 127.2 pm, que es más corta que un enlace simple O-O típico (148 pm) y más larga que el enlace doble O = O en O 2 [ 19459032] (120.7 pm).
Las estructuras de puntos de Lewis equivalentes, como las del ozono, se denominan estructuras de resonancia . La posición de los átomos es la misma en las diversas estructuras de resonancia de un compuesto, pero la posición de los electrones es diferente. Las flechas de dos puntas vinculan las diferentes estructuras de resonancia de un compuesto:
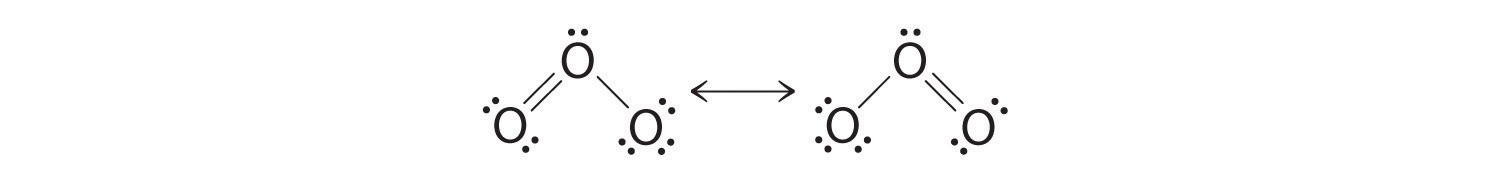
La flecha de dos puntas indica que la estructura electrónica real es un promedio de las mostradas, no que la molécula oscila entre las dos estructuras.
Cuando es posible escribir más de una estructura de resonancia equivalente para una molécula o ion, la estructura real es el promedio de las estructuras de resonancia.
El carbonato ( (CO_3 ^ {2−} )) Ion
Al igual que el ozono, la estructura electrónica del ion carbonato no puede ser descrita por una sola estructura electrónica de Lewis. Sin embargo, a diferencia de O 3 , la estructura real de CO 3 2− es un promedio de tres estructuras de resonancia.
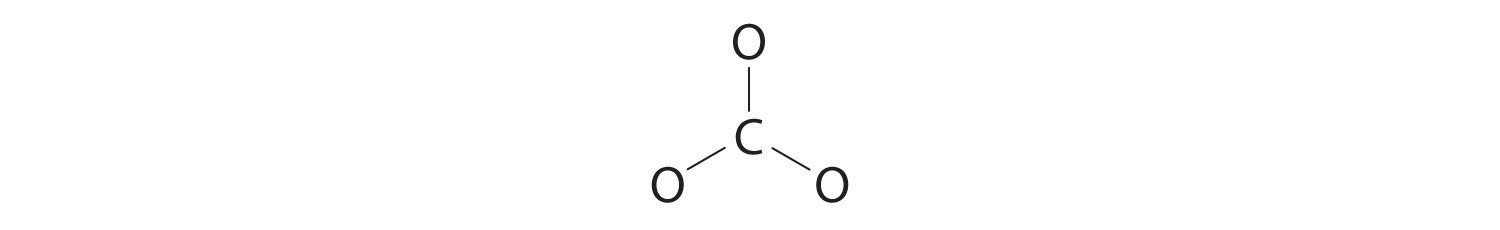
1. Debido a que el carbono es el elemento menos electronegativo, lo colocamos en la posición central:

2. El carbono tiene 4 electrones de valencia, cada oxígeno tiene 6 electrones de valencia, y hay 2 más para la carga −2. Esto da 4 + (3 × 6) + 2 = 24 electrones de valencia.
3. Se utilizan seis electrones para formar tres pares de enlace entre los átomos de oxígeno y el carbono:
4. Dividimos los 18 electrones restantes por igual entre los tres átomos de oxígeno colocando tres pares solitarios en cada uno e indicando la carga −2:
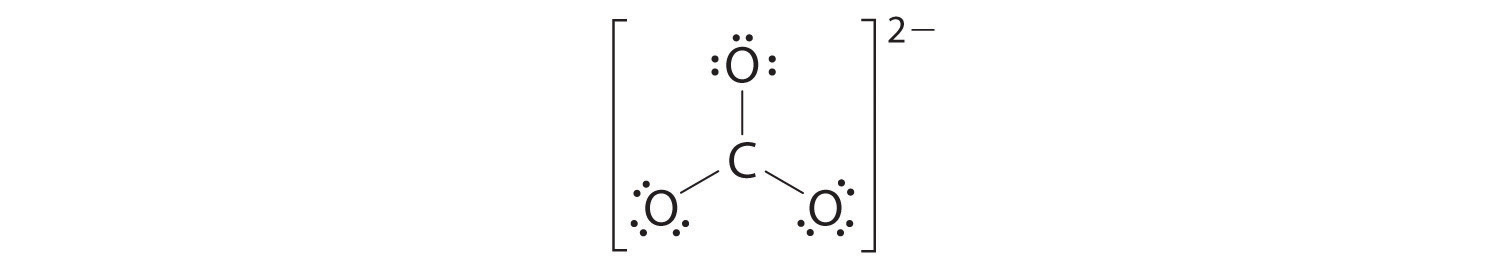
5. No quedan electrones para el átomo central.
6. En este punto, el átomo de carbono tiene solo 6 electrones de valencia, por lo que debemos tomar un par solitario de un oxígeno y usarlo para formar un doble enlace carbono-oxígeno. En este caso, sin embargo, hay tres opciones posibles:
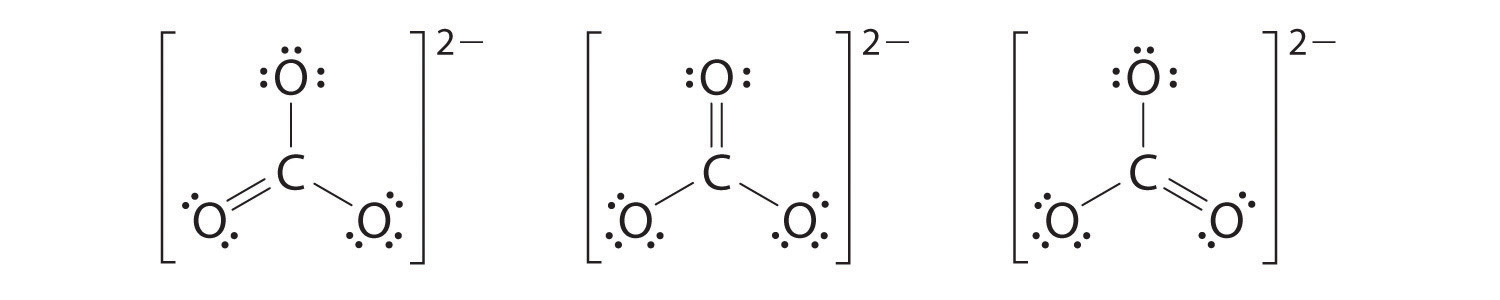
Al igual que con el ozono, ninguna de estas estructuras describe exactamente la unión. Cada uno predice un doble enlace carbono-oxígeno y dos enlaces simples carbono-oxígeno, pero experimentalmente todas las longitudes de enlace C-O son idénticas. Podemos escribir estructuras de resonancia (en este caso, tres de ellas) para el ion carbonato:
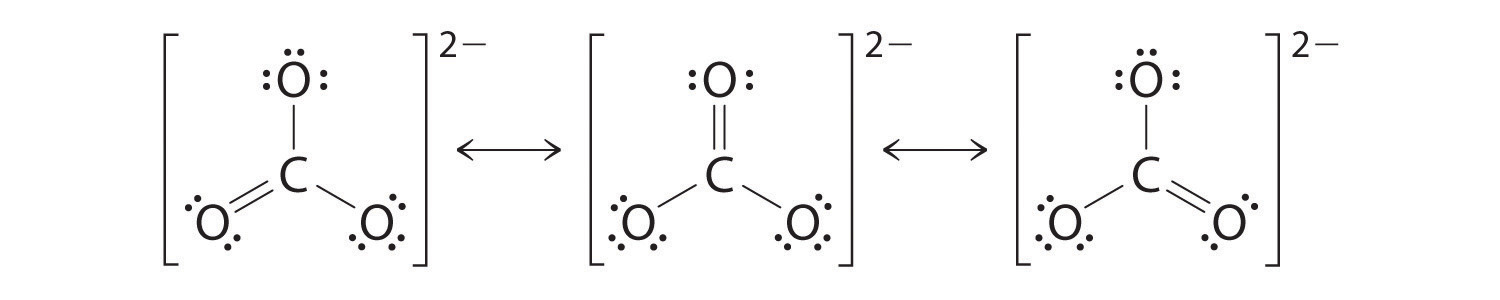
La estructura real es un promedio de estas tres estructuras de resonancia.
El ion nitrato ( (NO_3 ^ – ))
1. Cuente los electrones de valencia: (1 * 5) + (3 * 6) + 1 (ion) = 24 electrones
2. Dibuje las conectividades de enlace:
3. Agregue electrones octetos a los átomos unidos al átomo central:
4. Coloque los electrones sobrantes (24-24 = 0 ) en el átomo central:
5. ¿El átomo central tiene un octeto?
- NO , tiene 6 electrones
- Agregue un enlace múltiple (primero intente un enlace doble) para ver si el átomo central puede lograr un octeto:
6. ¿El átomo central tiene un octeto?
- SÍ
- ¿Hay posibles estructuras de resonancia? SÍ
Nota: Es de esperar que las longitudes de enlace en el ion ( ce {NO_3 ^ {-}} ) sean algo más cortas que un enlace simple.
Resumen
Algunas moléculas tienen dos o más estructuras electrónicas de Lewis químicamente equivalentes, llamadas estructuras de resonancia. La resonancia es un ejercicio mental y un método dentro de la Teoría del enlace de valencia del enlace que describe la deslocalización de electrones dentro de las moléculas. Estas estructuras están escritas con una flecha de doble punta entre ellas, lo que indica que ninguna de las estructuras de Lewis describe con precisión la unión, pero que la estructura real es un promedio de las estructuras de resonancia individuales. Las estructuras de resonancia se usan cuando una estructura de Lewis para una sola molécula no puede describir completamente el enlace que tiene lugar entre los átomos vecinos en relación con los datos empíricos para las longitudes de enlace reales entre esos átomos. La suma neta de estructuras de resonancia válidas se define como un híbrido de resonancia, que representa la deslocalización general de los electrones dentro de la molécula. Una molécula que tiene varias estructuras de resonancia es más estable que una con menos. Algunas estructuras de resonancia son más favorables que otras.