¿Por qué algunas sustancias son moléculas unidas químicamente y otras son una asociación de iones? La respuesta a esta pregunta depende de las estructuras electrónicas de los átomos y la naturaleza de las fuerzas químicas dentro de los compuestos. Aunque no hay límites bien definidos, los enlaces químicos generalmente se clasifican en tres tipos principales: enlaces iónicos, enlaces covalentes y enlaces metálicos. En este capítulo, se discutirá cada tipo de enlace y se encontrarán las propiedades generales en las sustancias típicas en las que se produce el tipo de enlace
- Los enlaces iónicos son el resultado de fuerzas electrostáticas que existen entre iones de carga opuesta . Estos enlaces típicamente involucran un metal con un no metal
- Los enlaces covalentes resultan del intercambio de electrones entre dos átomos . Los enlaces típicamente involucran un elemento no metálico con otro
- Enlaces metálicos Estos enlaces se encuentran en metales sólidos (cobre, hierro, aluminio) con cada metal unido a varios grupos vecinos y uniendo electrones para moverse libremente a través de la estructura tridimensional.
Cada clasificación de bonos se analiza en detalle en las secciones posteriores del capítulo. Veamos las disposiciones preferidas de los electrones en los átomos cuando forman compuestos químicos.
Símbolos de Lewis
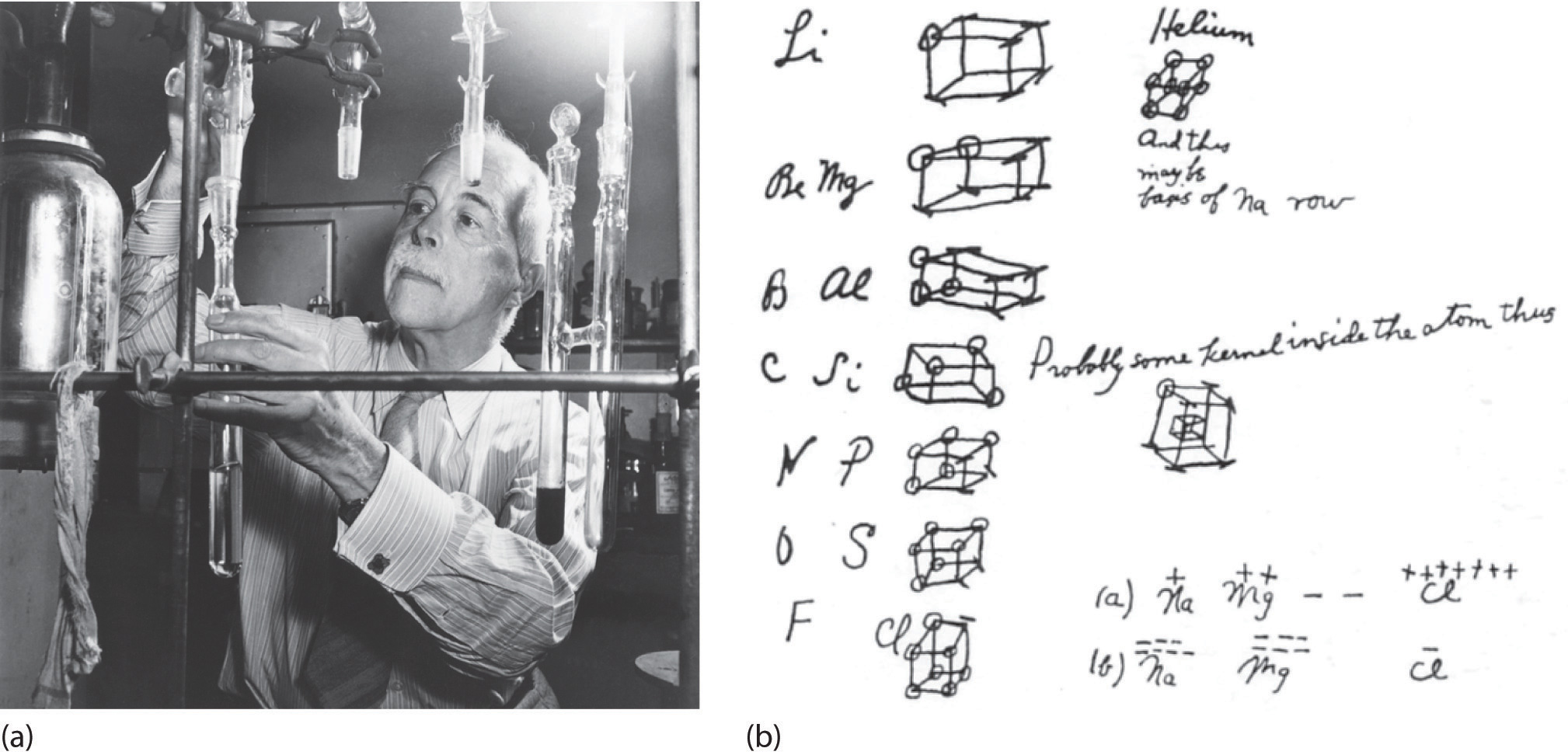
A principios del siglo XX , el químico estadounidense GN Lewis (1875–1946) ideó un sistema de símbolos, ahora llamado símbolos de puntos de electrones de Lewis (a menudo abreviado como Símbolos de puntos de Lewis ) que se pueden usar para predecir el número de enlaces formados por la mayoría de los elementos en sus compuestos. Cada símbolo de punto de Lewis consiste en el símbolo químico de un elemento rodeado de puntos que representan sus electrones de valencia.
Para escribir el símbolo de punto Lewis de un elemento, colocamos puntos que representan sus electrones de valencia, uno a la vez, alrededor del símbolo químico del elemento. Se colocan hasta cuatro puntos arriba, abajo, a la izquierda y a la derecha del símbolo (en cualquier orden, siempre que los elementos con cuatro o menos electrones de valencia no tengan más de un punto en cada posición). Los siguientes puntos, para elementos con más de cuatro electrones de valencia, se distribuyen de nuevo uno a la vez, cada uno emparejado con uno de los primeros cuatro. Por ejemplo, la configuración electrónica para el azufre atómico es [Ne] 3s 2 3p 4 , por lo tanto hay seis electrones de valencia. Su símbolo de Lewis sería:
El flúor, por ejemplo, con la configuración electrónica [He] 2 s 2 2 p 5 , tiene siete electrones de valencia , por lo que su símbolo de punto Lewis se construye de la siguiente manera:

Lewis usó los puntos no apareados para predecir el número de enlaces que formará un elemento en un compuesto. Considere el símbolo de nitrógeno en la figura 8.1.2. El símbolo de punto de Lewis explica por qué el nitrógeno, con tres electrones de valencia no apareados, tiende a formar compuestos en los que comparte los electrones no apareados para formar tres enlaces. El boro, que también tiene tres electrones de valencia no apareados en su símbolo de punto de Lewis, también tiende a formar compuestos con tres enlaces, mientras que el carbono, con cuatro electrones de valencia no apareados en su símbolo de punto de Lewis, tiende a compartir todos sus electrones de valencia no apareados formando compuestos en el que tiene cuatro enlaces.
La regla del octeto
En 1904, Richard Abegg formuló lo que ahora se conoce como la regla de Abegg , que establece que la diferencia entre las valencias máximas positivas y negativas de un elemento es con frecuencia ocho. Esta regla se usó más tarde en 1916 cuando Gilbert N. Lewis formuló la “regla del octeto” en su teoría del átomo cúbico. La regla del octeto se refiere a la tendencia de los átomos a preferir tener ocho electrones en la capa de valencia . Cuando los átomos tienen menos de ocho electrones, tienden a reaccionar y formar compuestos más estables. Los átomos reaccionarán para llegar al estado más estable posible. Un octeto completo es muy estable porque todos los orbitales estarán llenos. Los átomos con mayor estabilidad tienen menos energía, por lo que una reacción que aumenta la estabilidad de los átomos liberará energía en forma de calor o luz; las reacciones que disminuyen la estabilidad deben absorber energía, enfriándose.
Cuando discutimos la regla del octeto, no consideramos los electrones d o f . Solo los electrones syp están involucrados en la regla del octeto, por lo que es una regla útil para los elementos del grupo principal (elementos que no están en el metal de transición o en los bloques de metal de transición interna); un octeto en estos átomos corresponde a una configuración electrónica que termina con s 2 p 6 .
- Normalmente dos electrones se emparejan y forman un enlace, por ejemplo, (H_2 )
- Para la mayoría de los átomos habrá un máximo de ocho electrones en la capa de valencia (estructura de octeto), por ejemplo, (CH_4 )
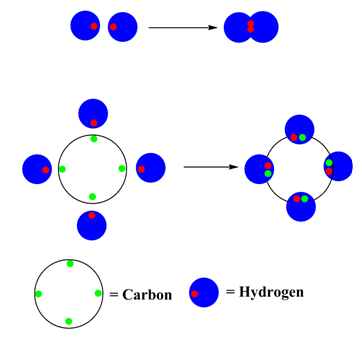
La otra tendencia de los átomos es mantener una carga neutra. Solo los gases nobles (los elementos en la columna más a la derecha de la tabla periódica) tienen carga cero con octetos de valencia llenos. Todos los demás elementos tienen una carga cuando tienen ocho electrones para sí mismos. El resultado de estos dos principios rectores es la explicación de gran parte de la reactividad y la unión que se observa dentro de los átomos: los átomos buscan compartir electrones de una manera que minimice la carga mientras se cumple un octeto en la capa de valencia.
Los símbolos de puntos de Lewis también se pueden usar para representar los iones en compuestos iónicos. La reacción de cesio con flúor, por ejemplo, para producir el compuesto iónico CsF se puede escribir de la siguiente manera:

No se muestran puntos en Cs + en el producto porque el cesio ha perdido su único electrón de valencia debido al flúor. La transferencia de este electrón produce el ion Cs + , que tiene la configuración electrónica de valencia de Xe, y el ion F – , que tiene un total de ocho electrones de valencia (un octeto) y la configuración de electrones Ne. Esta descripción es consistente con la afirmación de que entre los elementos del grupo principal, los iones en compuestos iónicos binarios simples generalmente tienen las configuraciones electrónicas del gas noble más cercano. La carga de cada ion está escrita en el producto, y el anión y sus electrones están encerrados entre paréntesis. Esta notación enfatiza que los iones están asociados electrostáticamente; no se comparten electrones entre los dos elementos.
Los átomos a menudo ganan, pierden o comparten electrones para lograr la misma cantidad de electrones que el gas noble más cercano a ellos en la tabla periódica.
Como es de esperar para un enfoque tan cualitativo de la vinculación, hay excepciones a la regla del octeto, que describimos en otra parte. Estos incluyen moléculas en las que uno o más átomos contienen menos o más de ocho electrones.
Resumen
Los símbolos de puntos de Lewis se pueden usar para predecir el número de enlaces formados por la mayoría de los elementos en sus compuestos. Una forma conveniente de predecir el número y la disposición básica de los enlaces en los compuestos es mediante el uso de símbolos de puntos de electrones de Lewis , que consisten en el símbolo químico de un elemento rodeado de puntos que representan sus electrones de valencia, agrupados a menudo en pares colocado arriba, abajo y a la izquierda y derecha del símbolo. Las estructuras reflejan el hecho de que los elementos en el período 2 y posteriores tienden a ganar, perder o compartir electrones para alcanzar un total de ocho electrones de valencia en sus compuestos, la llamada regla del octeto . El hidrógeno, con solo dos electrones de valencia, no obedece la regla del octeto.
Colaboradores
-
Mike Blaber ( Universidad Estatal de Florida )
- Wikipedia
- Programa Nacional de Tecnología de Aprendizaje Mejorado (India)