Hemos visto que cuando los elementos reaccionan, a menudo ganan o pierden suficientes electrones para lograr la configuración electrónica de valencia del gas noble más cercano. ¿Por qué esto es tan? En esta sección, desarrollamos un enfoque más cuantitativo para predecir tales reacciones al examinar las tendencias periódicas en los cambios de energía que acompañan a la formación de iones.
Energías de ionización
Debido a que los átomos no pierden electrones espontáneamente, se requiere energía para eliminar un electrón de un átomo para formar un catión. Los químicos definen la energía de ionización ( (I )) de un elemento como la cantidad de energía necesaria para eliminar un electrón del átomo gaseoso (E ) en su estado fundamental. (I ) es, por lo tanto, la energía requerida para la reacción
[E _ {(g)} rightarrow E ^ + _ {(g)} + e ^ – ; ; text {energy required = I} label {7.4.1} ] [19459010 ]
Debido a que se requiere una entrada de energía, la energía de ionización siempre es positiva ( (I> 0 )) para la reacción como se escribe en la Ecuación ( PageIndex {1} ). Los valores más grandes de I significan que el electrón está más unido al átomo y es más difícil de eliminar. Las unidades típicas para las energías de ionización son kilojulios / mol (kJ / mol) o electronvoltios (eV):
[1 ; eV / átomo = 96.49 ; kJ / mol ]
Si un átomo posee más de un electrón, la cantidad de energía necesaria para eliminar electrones sucesivos aumenta de manera constante. Podemos definir una primera energía de ionización ( (I_1 )), una segunda energía de ionización ( (I_2 )) y, en general, una enésima energía de ionización ( (I_n )) de acuerdo con las siguientes reacciones:
[ ce {E (g) rightarrow E ^ + (g) + e ^ -} ; ; I_1 = text {1st ionization energy} label {7.4.2} ] [19459010 ]
[ ce {E ^ {+} (g) rightarrow E ^ {2 +} (g) + e ^ -} ; ; I_2 = text {2nd ionization energy} label {7.4 .3} ]
[ ce {E ^ {2 +} (g) rightarrow E ^ {3 +} (g) + e ^ -} ; ; I_3 = text {3rd energía de ionización} label { 7.4.4} ]
Los valores para las energías de ionización de (Li ) y (Be ) enumeradas en la Tabla ( PageIndex {1} ) muestran que las energías de ionización sucesivas para un elemento aumentan a medida que avanzan; es decir, se necesita más energía para eliminar el segundo electrón de un átomo que el primero, y así sucesivamente. Hay dos razones para esta tendencia. Primero, el segundo electrón se está eliminando de una especie cargada positivamente en lugar de una neutral, por lo que de acuerdo con la ley de Coulomb, se requiere más energía. En segundo lugar, eliminar el primer electrón reduce las fuerzas repulsivas entre los electrones restantes, por lo que la atracción de los electrones restantes hacia el núcleo es más fuerte.
Las energías de ionización sucesivas para un elemento aumentan .
| Reacción | Transición electrónica | (I ) | Reacción | Transición electrónica | (I ) |
|---|---|---|---|---|---|
| ( ce {Li (g) rightarrow Li ^ + (g) + e ^ -} ) | (1s ^ 22s ^ 1 rightarrow 1s ^ 2 ) | I 1 = 520,2 | ( ce {Be (g) rightarrow Be ^ + (g) + e ^ -} ) | (1s ^ 22s ^ 2 rightarrow 1s ^ 22s ^ 1 ) | I 1 = 899,5 |
| ( ce {Li ^ + (g) rightarrow Li ^ {2 +} (g) + e ^ -} ) | (1s ^ 2 rightarrow 1s ^ 1 ) | I 2 = 7298,2 | ( ce {Be ^ + (g) rightarrow Be ^ {2 +} (g) + e ^ -} ) | (1s ^ 22s ^ 1 rightarrow 1s ^ 2 ) | I 2 = 1757,1 |
| ( ce {Li ^ {2+} (g) rightarrow Li ^ {3 +} (g) + e ^ -} ) | (1s ^ 1 rightarrow 1s ^ 0 ) | I 3 = 11,815.0 | ( ce {Be ^ {2 +} (g) rightarrow Be ^ {3 +} (g) + e ^ -} ) | (1s ^ 2 rightarrow 1s ^ 1 ) | I 3 = 14,848.8 |
| ( ce {Be ^ {3 +} (g) rightarrow Be ^ {4 +} (g) + e ^ -} ) | (1s ^ 1 rightarrow 1s ^ 0 ) | I 4 = 21,006.6 |
Sin embargo, el aumento en las energías de ionización sucesivas no es lineal, sino que aumenta drásticamente cuando se eliminan electrones en orbitales (n ) inferiores más cercanos al núcleo. La consecuencia más importante de los valores enumerados en la Tabla ( PageIndex {1} ) es que la química de ( ce {Li} ) está dominada por el ion ( ce {Li ^ +} ), mientras que la química de ( ce {Be} ) está dominada por el estado de oxidación +2. La energía requerida para eliminar el segundo electrón de ( ce {Li} ):
[ ce {Li ^ + (g) rightarrow Li ^ {2 +} (g) + e ^ -} label {7.4.5} ]
es más de 10 veces mayor que la energía necesaria para eliminar el primer electrón. Del mismo modo, la energía requerida para eliminar el tercer electrón de ( ce {Be} ):
[ ce {Be ^ {2 +} (g) rightarrow Be ^ {3 +} (g) + e ^ -} label {7.4.6} ]
es aproximadamente 15 veces mayor que la energía necesaria para eliminar el primer electrón y alrededor de 8 veces mayor que la energía requerida para eliminar el segundo electrón. Tanto ( ce {Li ^ +} ) como ( ce {Be ^ {2 +}} ) tienen 1 s 2 configuraciones de capa cerrada, y mucho se requiere más energía para eliminar un electrón del núcleo 1 s 2 que del orbital de valencia 2 s del mismo elemento. Las consecuencias químicas son enormes: el litio (y todos los metales alcalinos) forman compuestos con el ion 1+ pero no con los iones 2+ o 3+. De manera similar, el berilio (y todos los metales alcalinotérreos) forma compuestos con el ion 2+ pero no con los iones 3+ o 4+. La energía requerida para eliminar electrones de un núcleo lleno es prohibitivamente grande y simplemente no se puede lograr en reacciones químicas normales.
La energía requerida para eliminar electrones de un núcleo lleno es prohibitivamente grande en condiciones normales de reacción.
Energías de ionización de s – y p -Elementos de bloqueo
Las energías de ionización de los elementos en la tercera fila de la tabla periódica exhiben el mismo patrón que las de (Li ) y (Be ) (Tabla ( PageIndex {2} )): energías de ionización sucesivas aumenta constantemente a medida que se eliminan los electrones de los orbitales de valencia (3 s o 3 p , en este caso), seguido de un aumento especialmente grande en la energía de ionización cuando los electrones se eliminan del núcleo lleno niveles como lo indica la línea diagonal en negrita en la Tabla ( PageIndex {2} ). Por lo tanto, en la tercera fila de la tabla periódica, el mayor aumento en la energía de ionización corresponde a eliminar el cuarto electrón de (Al ), el quinto electrón de Si, y así sucesivamente, es decir, eliminar un electrón de un ion que tiene La configuración electrónica de valencia del gas noble precedente. Este patrón explica por qué la química de los elementos normalmente involucra solo electrones de valencia. Se requiere demasiada energía para eliminar o compartir los electrones internos.
| Elemento | (I_1 ) | (I_2 ) | (I_3 ) | (I_4 ) | (I_5 ) | (I_6 ) | (I_7 ) |
|---|---|---|---|---|---|---|---|
| * Electrón de capa interna | |||||||
| Na | 495,8 | 4562,4 * | – | – | – | – | – |
| Mg | 737,7 | 1450,7 | 7732,7 | – | – | – | – |
| Al | 577.4.4 | 1816,7 | 2744,8 | 11,577.4.4 | – | – | – |
| Si | 786,5 | 1577,1 | 3231,6 | 4355,5 | 16,090.6 | – | – |
| P | 1011,8 | 1907.4.4 | 2914,1 | 4963,6 | 6274,0 | 21,267.4.3 | – |
| S | 999,6 | 2251,8 | 3357 | 4556,2 | 7004,3 | 8495,8 | 27,107.4.3 |
| Cl | 1251,2 | 2297,7 | 3822 | 5158,6 | 6540 | 9362 | 11,018.2 |
| Ar | 1520,6 | 2665,9 | 3931 | 5771 | 7238 | 8781,0 | 11,995.3 |
La primera columna de datos en la Tabla ( PageIndex {2} ) muestra que las primeras energías de ionización tienden a aumentar en la tercera fila de la tabla periódica. Esto se debe a que los electrones de valencia no se protegen entre sí muy bien, lo que permite que la carga nuclear efectiva aumente constantemente a lo largo de la fila. Por lo tanto, los electrones de valencia son atraídos más fuertemente al núcleo, por lo que los tamaños atómicos disminuyen y las energías de ionización aumentan. Estos efectos representan dos caras de la misma moneda: las interacciones electrostáticas más fuertes entre los electrones y el núcleo aumentan aún más la energía necesaria para eliminar los electrones.
Sin embargo, la primera energía de ionización disminuye en Al ([Ne] 3 s 2 3 p 1 ) y en S ([Ne] 3 s 2 3 p 4 ). Las configuraciones electrónicas de estas “excepciones” proporcionan la respuesta por qué. Los electrones en el aluminio lleno de 3 s 2 subshell son mejores en la detección del electrón 3 p 1 que en la detección entre ellos la carga nuclear, por lo que los electrones s penetran más cerca del núcleo que el electrón p y el electrón p se elimina más fácilmente. La disminución en S ocurre porque los dos electrones en el mismo orbital p se repelen entre sí. Esto hace que el átomo S sea un poco menos estable de lo que se esperaría, como es el caso de todos los elementos del grupo 16.
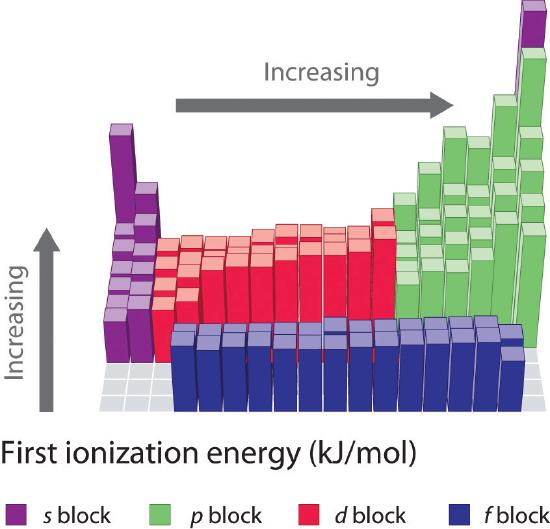
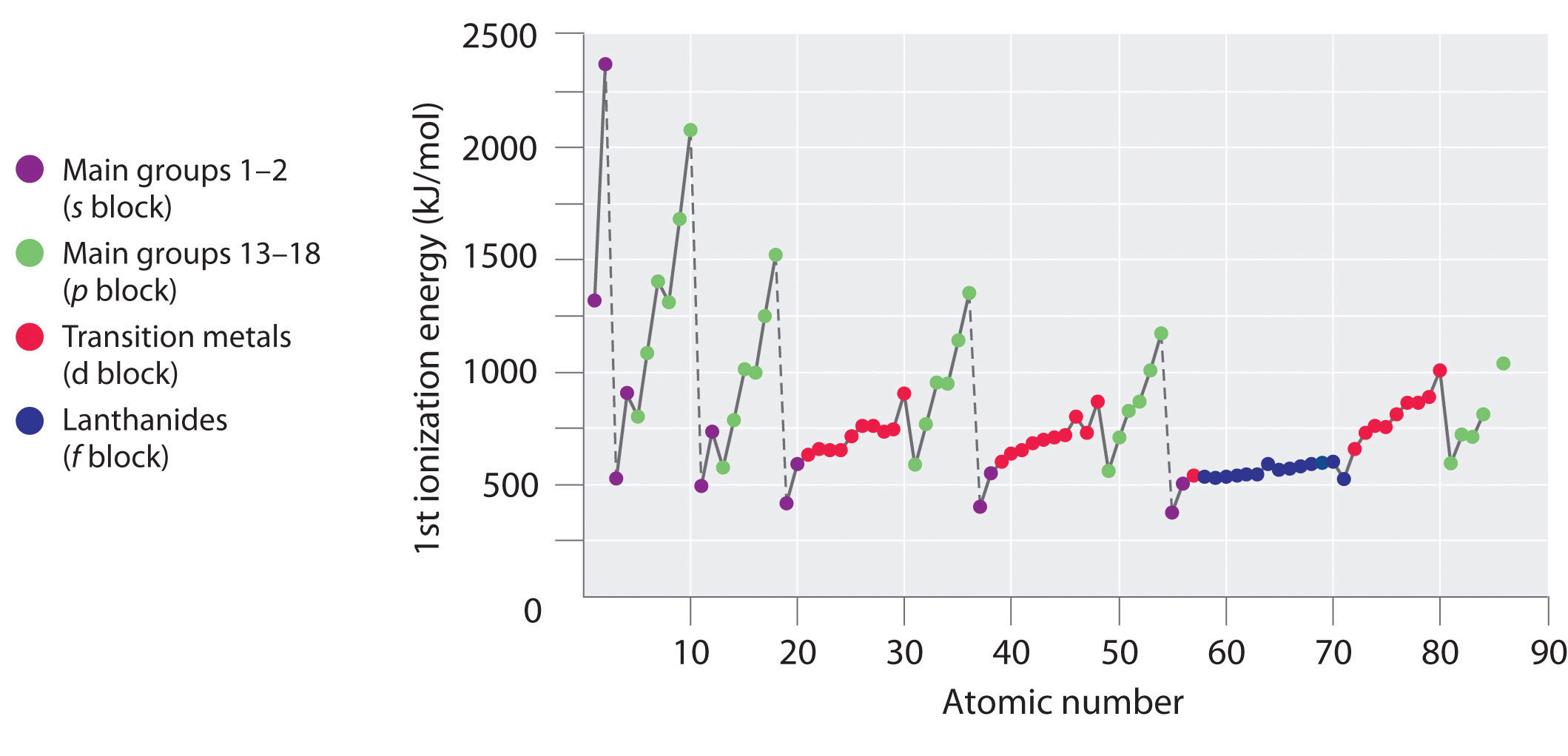
Las primeras energías de ionización de los elementos en las primeras seis filas de la tabla periódica se representan en la Figura ( PageIndex {1} ) y se presentan numérica y gráficamente en la Figura ( PageIndex {2} ). Estas cifras ilustran tres tendencias importantes:
- Los cambios observados en las filas segunda (Li a Ne), cuarta (K a Kr), quinta (Rb a Xe) y sexta (Cs a Rn) de las s y p bloques siguen un patrón similar al patrón descrito para la tercera fila de la tabla periódica. Sin embargo, los metales de transición se incluyen en la cuarta, quinta y sexta filas, y los lantánidos se incluyen en la sexta fila. Las primeras energías de ionización de los metales de transición son algo similares entre sí, al igual que las de los lantánidos. Las energías de ionización aumentan de izquierda a derecha en cada fila, con discrepancias en ns 2 np 1 (grupo 13), [19459016 ] ns 2 np 4 (grupo 16) y ns 2 ( n – 1) d 10 (grupo 12).
- Las primeras energías de ionización generalmente disminuyen en una columna. Aunque el número cuántico principal n aumenta en una columna, las capas internas llenas son efectivas para detectar los electrones de valencia, por lo que hay un aumento relativamente pequeño en la carga nuclear efectiva. En consecuencia, los átomos se hacen más grandes a medida que adquieren electrones. Los electrones de valencia que están más lejos del núcleo están menos unidos, lo que los hace más fáciles de eliminar, lo que hace que disminuyan las energías de ionización. Un radio mayor generalmente corresponde a una energía de ionización más baja .
- Debido a las dos primeras tendencias, los elementos que forman iones positivos más fácilmente (tienen las energías de ionización más bajas) se encuentran en la esquina inferior izquierda de la tabla periódica, mientras que los que son más difíciles de ionizar se encuentran en la esquina superior derecha de la tabla periodica. En consecuencia, las energías de ionización generalmente aumentan diagonalmente desde la parte inferior izquierda (Cs) a la superior derecha (He).

En general, (I_1 ) aumenta diagonalmente desde la esquina inferior izquierda de la tabla periódica hasta la esquina superior derecha.
El galio (Ga), que es el primer elemento que sigue a la primera fila de metales de transición, tiene la siguiente configuración electrónica: [Ar] 4 s 2 3 d 10 4 p 1 . Su primera energía de ionización es significativamente menor que la del elemento inmediatamente anterior, el zinc, porque la subcapa 3 d 10 llena de galio se encuentra dentro de la subcapa 4 p , protegiendo el solo electrón 4 p del núcleo. Los experimentos han revelado algo de mayor interés: el segundo y tercer electrones que se eliminan cuando se ioniza el galio provienen del orbital 4 s 2 , no el 3 d 10 subshell. La química del galio está dominada por el ion Ga 3+ resultante, con su configuración de electrones [Ar] 3 d 10 . Esta y otras configuraciones de electrones similares son particularmente estables y a menudo se encuentran en los elementos de bloque más pesados p . A veces se les conoce como configuraciones de gas pseudo noble . De hecho, para los elementos que exhiben estas configuraciones, no se conocen compuestos químicos en los que los electrones se eliminen de (n – 1) d 10 subshell lleno .
Energías de ionización de metales de transición y lantánidos
Como notamos, las primeras energías de ionización de los metales de transición y los lantánidos cambian muy poco en cada fila. Las diferencias en sus energías de ionización segunda y tercera también son bastante pequeñas, en marcado contraste con el patrón visto con los elementos de bloque s – y p . La razón de estas similitudes es que los metales de transición y los lantánidos forman cationes al perder los electrones ns antes de los ( n – 1) d o ([19459016 ] n – 2) f electrones, respectivamente. Esto significa que los cationes de metales de transición tienen ( n – 1) d n configuraciones de electrones de valencia, y los cationes lantánidos tienen ( n – 2) f n configuraciones de electrones de valencia. Debido a que ( n – 1) d y ( n – 2) f los depósitos están más cerca del núcleo que los ns carcasa, el ( n – 1) d y ( n – 2) f pantalla de electrones el ns electrones con bastante eficacia, reduciendo la carga nuclear efectiva que sienten los electrones ns . A medida que Z aumenta, la carga positiva creciente se cancela en gran medida por los electrones agregados a ( n – 1) d o ( n – 2) f orbitales.
Que los electrones ns se eliminan antes que ( n – 1) d o ( n – 2) f los electrones pueden sorprenderte porque los orbitales se llenaron en el orden inverso. De hecho, el ns , el ( n – 1) d , y el ( n – 2) f [ 19459017] los orbitales están tan cerca uno del otro en energía, y se interpenetran entre sí tan extensamente, que cambios muy pequeños en la carga nuclear efectiva pueden cambiar el orden de sus niveles de energía. A medida que se llenan los orbitales d , la carga nuclear efectiva hace que los orbitales 3 d sean ligeramente más bajos en energía que los 4 s . El [Ar] 3 d 2 configuración electrónica de Ti 2+ nos dice que los electrones de titanio 4 s se pierden antes que los electrones de titanio 3 d electrones; Esto se confirma por el experimento. Se observa un patrón similar con los lantánidos, produciendo cationes con una configuración de electrones de valencia ( n – 2) f n .
Debido a que sus energías de ionización primera, segunda y tercera cambian muy poco en una fila, estos elementos tienen importantes similitudes horizontales en propiedades químicas además de las similitudes verticales esperadas. Por ejemplo, todos los metales de transición de la primera fila, excepto el escandio, forman compuestos estables como iones M 2+ , mientras que los lantánidos forman principalmente compuestos en los que existen como iones M 3+ .
Resumen
La tendencia de un elemento a perder electrones es uno de los factores más importantes para determinar el tipo de compuestos que forma. El comportamiento periódico es más evidente para energía de ionización ( I ) , la energía requerida para eliminar un electrón de un átomo gaseoso. La energía requerida para eliminar electrones sucesivos de un átomo aumenta de manera constante, y se produce un aumento sustancial con la eliminación de un electrón de una capa interna llena. En consecuencia, solo los electrones de valencia pueden eliminarse en las reacciones químicas, dejando intacta la capa interna llena. Las energías de ionización explican los estados de oxidación comunes observados para los elementos. Las energías de ionización aumentan en diagonal desde la esquina inferior izquierda de la tabla periódica hasta la esquina superior derecha. Las desviaciones menores de esta tendencia pueden explicarse en términos de configuraciones electrónicas particularmente estables, llamadas configuraciones de gas pseudo noble , en el átomo original o en el ion resultante.