La configuración electrónica de un elemento es la disposición de sus electrones en sus orbitales atómicos. Al conocer la configuración electrónica de un elemento, podemos predecir y explicar gran parte de su química.
El principio de Aufbau
Construimos la tabla periódica siguiendo el principio aufbau (del alemán, que significa “construir”). Primero determinamos el número de electrones en el átomo; luego agregamos electrones uno a la vez al orbital de energía más baja disponible sin violar el principio de Pauli . Utilizamos el diagrama de energía orbital de la Figura ( PageIndex {1} ), reconociendo que cada orbital puede contener dos electrones, uno con giro hacia arriba ↑, correspondiente a m s [ 19459019] = + ½, que se escribe arbitrariamente primero, y uno con giro hacia abajo ↓, correspondiente a m s = −½. Un orbital lleno se indica con ↑ ↓, en el que se dice que los espines de electrones están emparejados . Aquí hay un diagrama orbital esquemático para un átomo de hidrógeno en su estado fundamental:
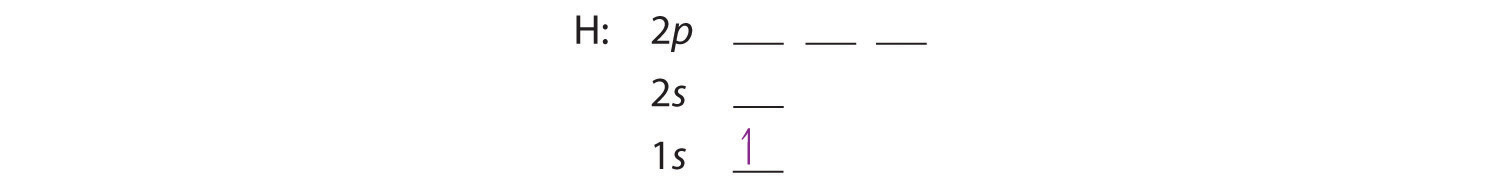
Del diagrama orbital, podemos escribir la configuración electrónica en una forma abreviada en la que los orbitales ocupados se identifican por su número cuántico principal n y su valor de l ([ 19459018] s , p , d o f ), con el número de electrones en la subcapa indicada por un superíndice. Por lo tanto, para el hidrógeno, el electrón individual se coloca en el orbital 1 s , que es el orbital más bajo en energía (Figura ( PageIndex {1} )), y la configuración electrónica se escribe como 1 s 1 y se lee como “one-s-one”.
Un átomo de helio neutro, con un número atómico de 2 ( Z = 2), tiene dos electrones. Colocamos un electrón en el orbital que tiene la energía más baja, el orbital 1 s . A partir del principio de exclusión de Pauli , sabemos que un orbital puede contener dos electrones con espín opuesto, por lo que colocamos el segundo electrón en el mismo orbital que el primero pero apuntando hacia abajo, de modo que los electrones estén emparejados. El diagrama orbital para el átomo de helio es, por lo tanto,
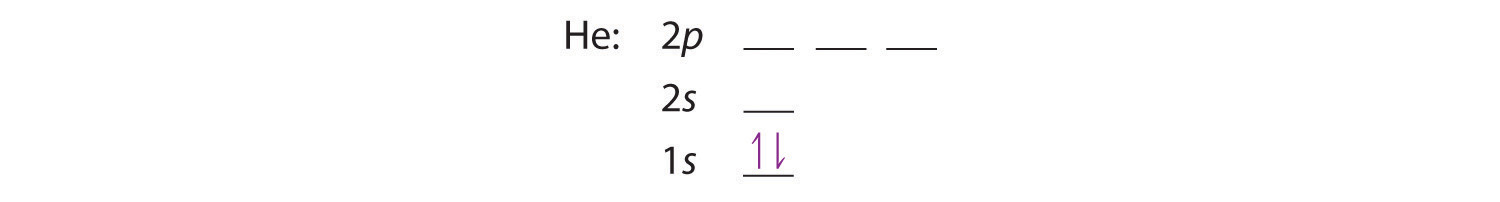
escrito como 1 s 2 , donde el superíndice 2 implica el emparejamiento de giros. De lo contrario, nuestra configuración violaría el principio de Pauli.
El siguiente elemento es litio, con Z = 3 y tres electrones en el átomo neutro. Sabemos que el orbital 1 s puede contener dos de los electrones con sus espines emparejados; El tercer electrón debe entrar en un orbital de mayor energía. La figura 6.29 nos dice que el siguiente orbital de energía más baja es 2 s , entonces el diagrama orbital para litio es
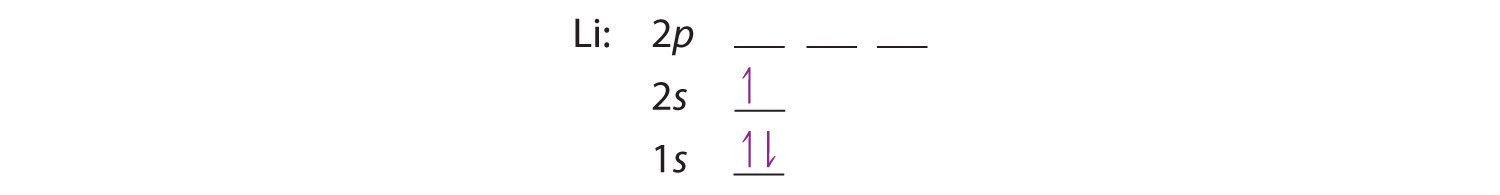
Esta configuración electrónica se escribe como 1 s 2 2 s 1 .
El siguiente elemento es el berilio, con Z = 4 y cuatro electrones. Llenamos los orbitales 1 s y 2 s para lograr un 1 s 2 2 s ] 2 configuración electrónica:
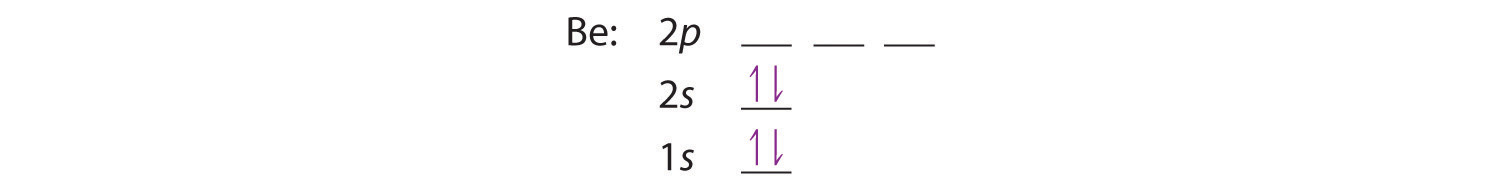
Cuando alcanzamos el boro, con Z = 5 y cinco electrones, debemos colocar el quinto electrón en uno de los 2 orbitales p . Como los tres orbitales 2 p están degenerados, no importa cuál seleccionemos. La configuración electrónica del boro es 1 s 2 2 s 2 2 p 1 ]:
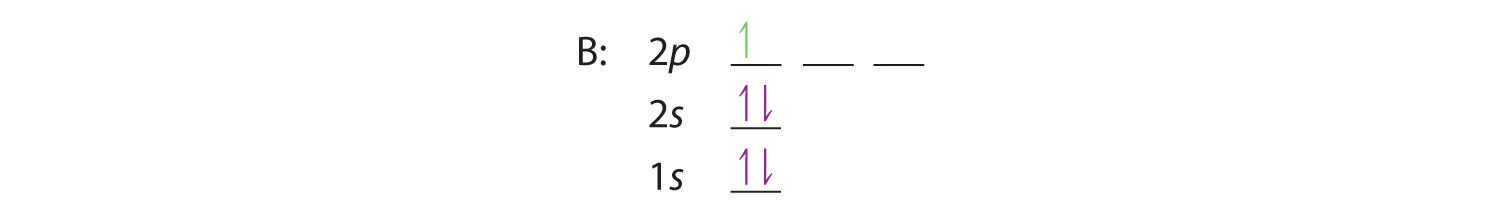
En carbono, con Z = 6 y seis electrones, nos enfrentamos a una elección. ¿Debería colocarse el sexto electrón en el mismo orbital 2 p que ya tiene un electrón, o debería ir en uno de los orbitales 2 p vacíos? Si va en un orbital 2 p vacío, ¿el sexto electrón tendrá su espín alineado o será opuesto al espín del quinto? En resumen, ¿cuál de los siguientes tres diagramas orbitales es correcto para el carbono, recordando que los orbitales 2 p están degenerados?
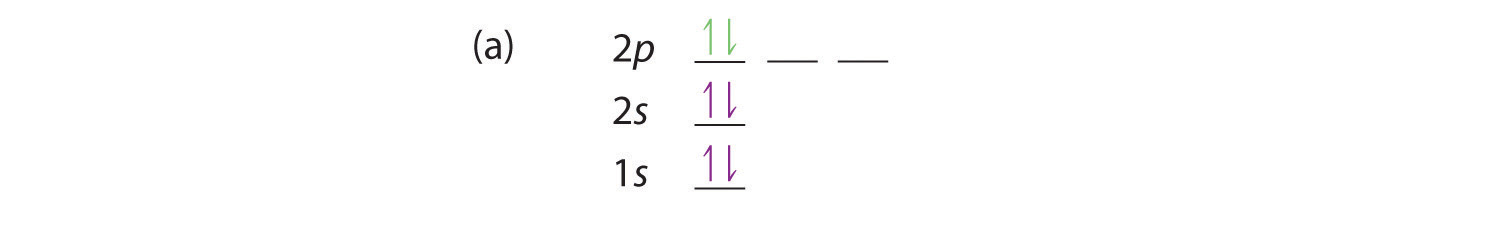
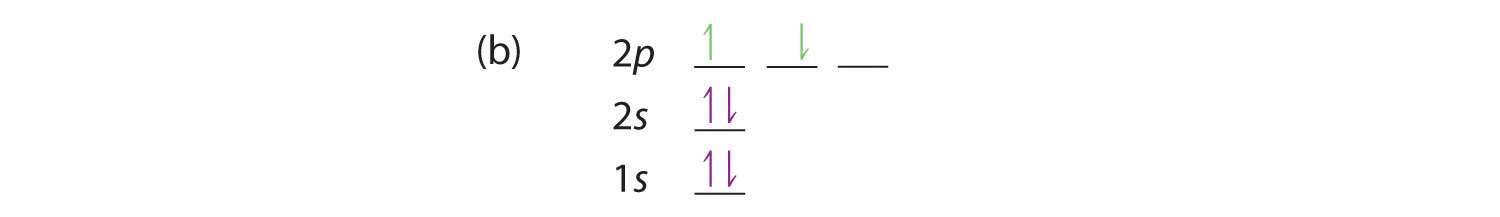
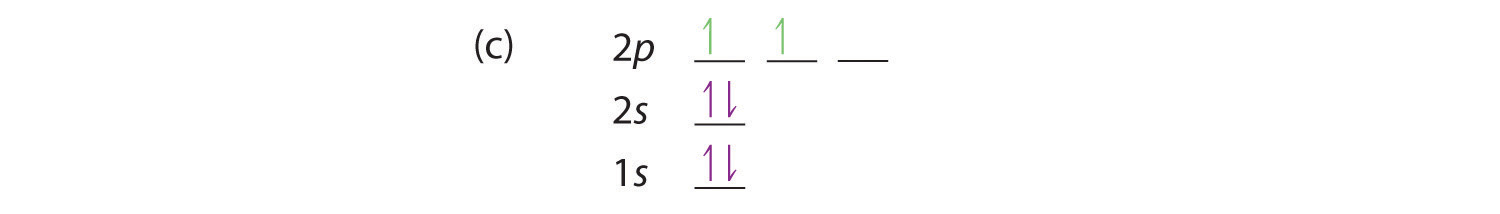
Debido a las interacciones electrón-electrón, es más favorable energéticamente que un electrón esté en un orbital desocupado que en uno que ya está ocupado; por lo tanto, podemos eliminar la opción a. De manera similar, los experimentos han demostrado que la opción b es ligeramente más alta en energía (menos estable) que la opción c porque los electrones en los orbitales degenerados prefieren alinearse con sus espines paralelos; por lo tanto, podemos eliminar la opción b. La opción c ilustra la regla de Hund (llamada así por el físico alemán Friedrich H. Hund, 1896–1997), que hoy dice que la configuración electrónica de energía más baja para un átomo es la que tiene el número máximo de electrones con espines paralelos en orbitales degenerados. Por la regla de Hund, la configuración electrónica del carbono, que es 1 s 2 2 s 2 2 p 2 , se entiende que corresponde al diagrama orbital que se muestra en c. Experimentalmente, se encuentra que el estado fundamental de un átomo de carbono neutro contiene dos electrones no apareados.
Cuando llegamos al nitrógeno ( Z = 7, con siete electrones), la regla de Hund nos dice que la disposición de energía más baja es
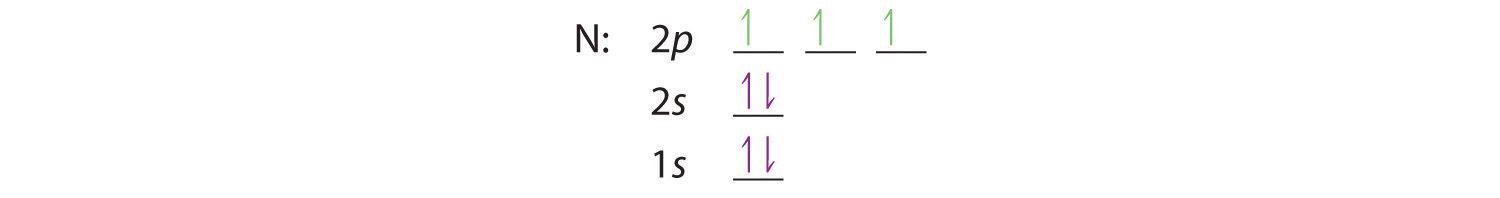
con tres electrones no apareados. La configuración electrónica del nitrógeno es, por lo tanto, 1 s 2 2 s 2 2 p 3 [ 19459028].
En oxígeno, con Z = 8 y ocho electrones, no tenemos otra opción. Un electrón debe estar emparejado con otro en uno de los 2 orbitales p , que nos da dos electrones no apareados y un 1 s 2 2 s [ 19459019] 2 2 p 4 configuración electrónica. Como todos los orbitales 2 p están degenerados, no importa cuál tenga el par de electrones.
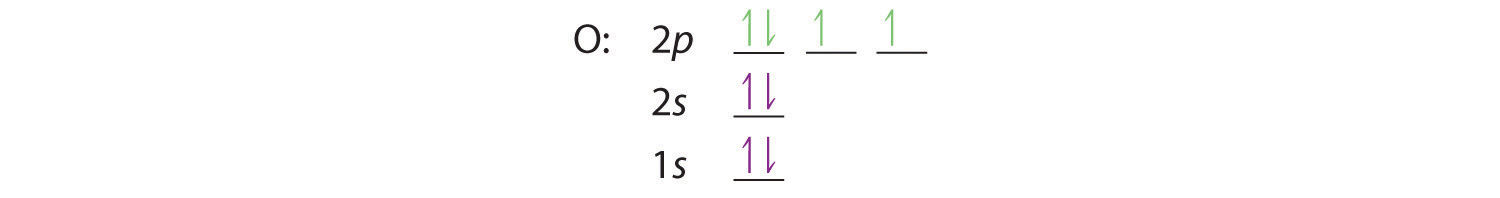
Del mismo modo, el flúor tiene la configuración electrónica 1 s 2 2 s 2 2 p [19459027 ] 5 :
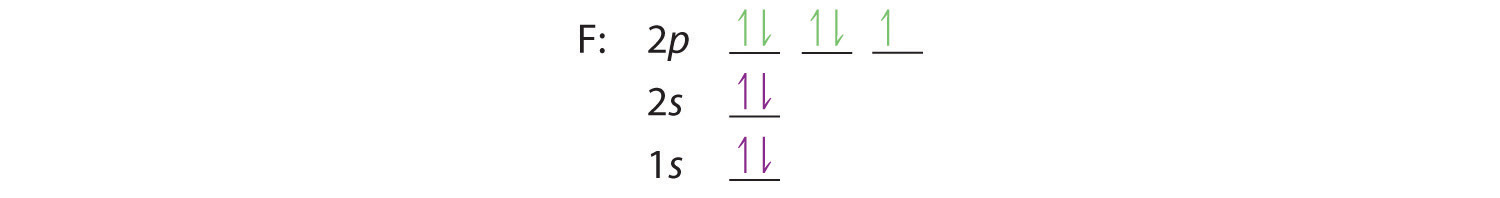
Cuando llegamos al neón, con Z = 10, hemos llenado el subshell 2 p , dando un 1 s 2 2 s 2 2 p 6 configuración electrónica:
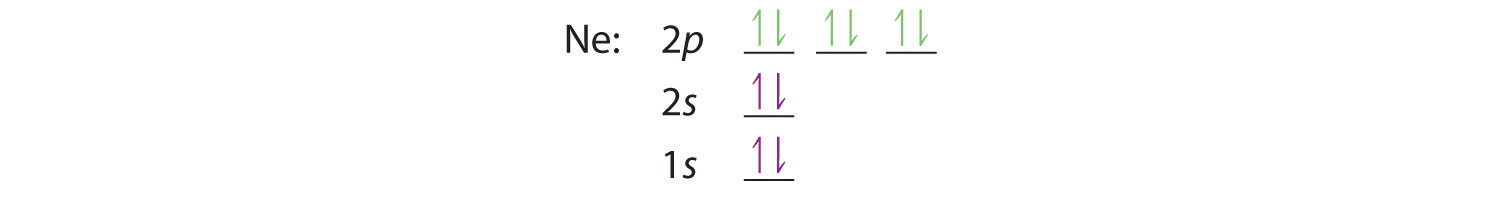
Observe que para el neón, como para el helio, todos los orbitales a través del nivel 2 p están completamente llenos. Este hecho es muy importante para dictar tanto la reactividad química como la unión de helio y neón, como verá.
Electrones de valencia
A medida que continuamos a través de la tabla periódica de esta manera, escribiendo las configuraciones electrónicas de átomos cada vez más grandes, se vuelve tedioso seguir copiando las configuraciones de las subcapas internas llenas. En la práctica, los químicos simplifican la notación al usar un símbolo de gas noble entre corchetes para representar la configuración del gas noble de la fila anterior porque todos los orbitales en un gas noble están llenos. Por ejemplo, [Ne] representa el 1 s 2 2 s 2 2 p 6 configuración electrónica de neón ( Z = 10), por lo que la configuración electrónica de sodio, con Z = 11, que es 1 s 2 2 s 2 2 p 6 3 s 1 , se escribe como [Ne] 3 s 1 :
| Neón | Z = 10 | 1 s 2 2 s 2 2 p 6 [19459055 ] |
| Sodio | Z = 11 | 1 s 2 2 s 2 2 p 6 [19459057 ] 3 s 1 = [Ne] 3 s 1 |
Debido a que los electrones en los orbitales internos llenos están más cerca del núcleo y más estrechamente unidos al mismo, rara vez están involucrados en reacciones químicas. Esto significa que la química de un átomo depende principalmente de los electrones en su capa más externa, que se llaman electrones de valencia . La notación simplificada nos permite ver la configuración de valencia-electrón más fácilmente. Usando esta notación para comparar las configuraciones electrónicas de sodio y litio, tenemos:
| Sodio | 1 s 2 2 s 2 2 p 6 3 [ 19459018] s 1 = [Ne] 3 s 1 |
| Litio | 1 s 2 2 s 1 = [He] 2 s 1 [ 19459028] |
Es evidente que tanto el sodio como el litio tienen un electrón s en su capa de valencia. Por lo tanto, podríamos predecir que el sodio y el litio tienen una química muy similar, que es el caso.
A medida que continuamos construyendo los ocho elementos del período 3, los orbitales 3 s y 3 p se llenan, un electrón a la vez. Esta fila concluye con el argón de gas noble, que tiene la configuración electrónica [Ne] 3 s 2 3 p 6 , correspondiente a Un caparazón de valencia lleno.
El orden general en el que se llenan los orbitales se representa en la Figura ( PageIndex {2} ). Las subcapas correspondientes a cada valor de n se escriben de izquierda a derecha en líneas horizontales sucesivas, donde cada fila representa una fila en la tabla periódica. El orden en que se llenan los orbitales se indica mediante las líneas diagonales que se extienden desde la parte superior derecha a la inferior izquierda. En consecuencia, el orbital 4 s se llena antes del orbital 3 d debido a los efectos de blindaje y penetración. En consecuencia, la configuración electrónica del potasio, que comienza el cuarto período, es [Ar] 4 s 1 , y la configuración del calcio es [Ar] 4 s [19459019 ] 2 . Cinco orbitales 3 d se llenan con los siguientes 10 elementos, los metales de transición, seguidos por tres orbitales 4 p . Observe que el último miembro de esta fila es el criptón de gas noble ( Z = 36), [Ar] 4 s 2 3 d [19459019 ] 10 4 p 6 = [Kr], que ha llenado 4 s , 3 d , y 4 p orbitales. La quinta fila de la tabla periódica es esencialmente la misma que la cuarta, excepto que los orbitales 5 s , 4 d y 5 p se llenan secuencialmente.
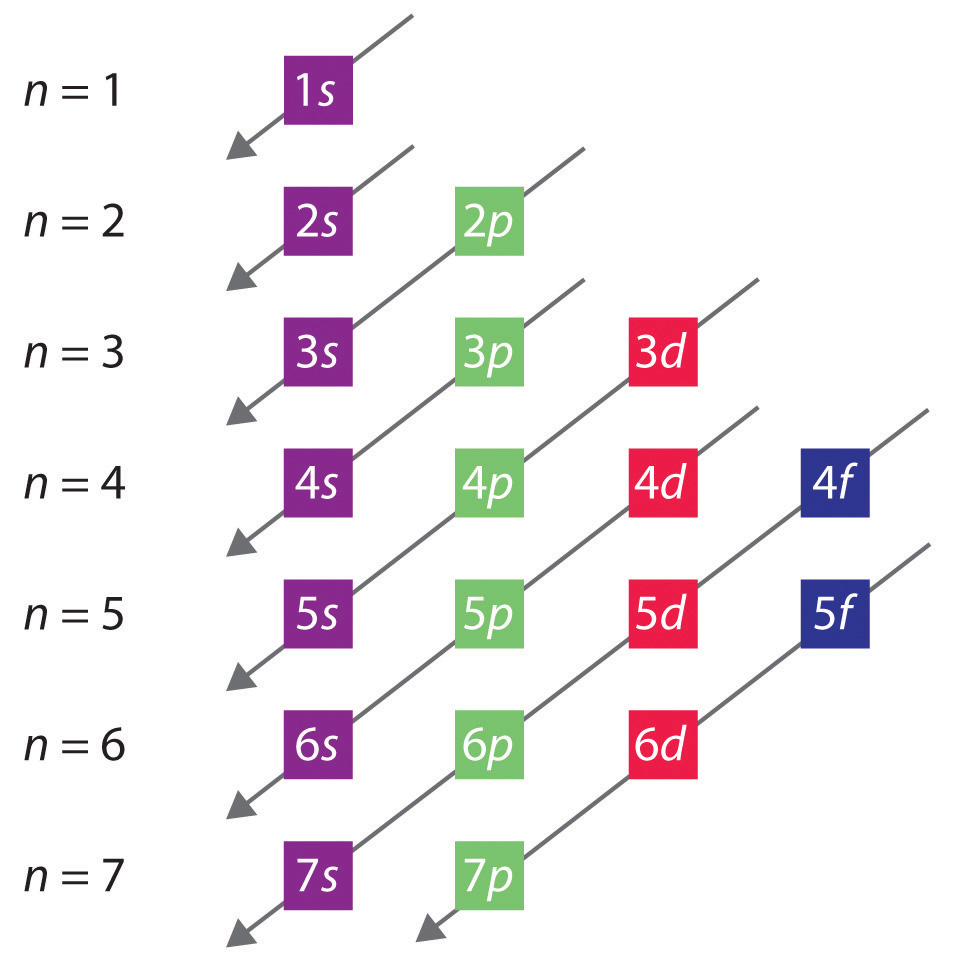
La sexta fila de la tabla periódica será diferente de las dos anteriores porque los 4 orbitales f , que pueden contener 14 electrones, se llenan entre los 6 s y los 5 d orbitales. Los elementos que contienen 4 orbitales f en su capa de valencia son los lantánidos. Cuando los orbitales 6 p finalmente se llenan, hemos alcanzado el siguiente gas noble, radón ( Z = 86), [Xe] 6 s 2 4 f 14 5 d 10 6 p 6 = [Rn]. En la última fila, los 5 orbitales f se rellenan entre los orbitales 7 s y 6 d , que proporciona los 14 elementos actínidos. Debido a que la gran cantidad de protones hace que sus núcleos sean inestables, todos los actínidos son radiactivos.
Las configuraciones electrónicas de los elementos se presentan en la Figura ( PageIndex {2} ), que enumera los orbitales en el orden en que se llenan. En varios casos, las configuraciones electrónicas del estado fundamental son diferentes de las predichas por la Figura ( PageIndex {1} ). Algunas de estas anomalías ocurren cuando los 3 orbitales d están llenos. Por ejemplo, la configuración electrónica de cromo en estado fundamental observada es [Ar] 4 s 1 3 d 5 en lugar de la predicha [ Ar] 4 s 2 3 d 4 . De manera similar, la configuración electrónica observada del cobre es [Ar] 4 s 1 3 d 10 en lugar de [Ar] s 2 3 d 9 . La configuración electrónica real puede racionalizarse en términos de una estabilidad adicional asociada con un medio lleno ( ns 1 , np 3 , nd 5 , nf 7 ) o lleno ( ns 2 , ] np 6 , nd 10 , nf 14 ) subshell. (De hecho, esta “estabilidad especial” es realmente otra consecuencia de la inestabilidad causada por el emparejamiento de un electrón con otro en el mismo orbital, como lo ilustra la regla de Hund). Dadas las pequeñas diferencias entre los niveles de energía más altos, Esta estabilidad adicional es suficiente para cambiar un electrón de un orbital a otro. En elementos más pesados, otros efectos más complejos también pueden ser importantes, lo que lleva a muchas anomalías adicionales. Por ejemplo, el cerio tiene una configuración electrónica de [Xe] 6 s 2 4 f 1 5 d 1 , que es imposible de racionalizar en términos simples. Sin embargo, en la mayoría de los casos, estas anomalías aparentes no tienen consecuencias químicas importantes.
Estabilidad adicional está asociada con subcapas medio llenas o llenas.
Resumen
Basado en el principio de Pauli y el conocimiento de las energías orbitales obtenidas usando orbitales similares al hidrógeno, es posible construir la tabla periódica llenando los orbitales disponibles comenzando con los orbitales de energía más baja (el principio de aufbau [ 19459043]), que da lugar a una disposición particular de electrones para cada elemento (su configuración electrónica ). La regla de Hund dice que la disposición de electrones de menor energía es la que los coloca en orbitales degenerados con sus espines paralelos. Para fines químicos, los electrones más importantes son aquellos en la capa principal más externa, los electrones de valencia .