La paradoja descrita por el principio de incertidumbre de Heisenberg y la naturaleza ondulatoria de las partículas subatómicas, como el electrón, hicieron imposible usar las ecuaciones de la física clásica para describir el movimiento de los electrones en los átomos. Los científicos necesitaban un nuevo enfoque que tuviera en cuenta el comportamiento ondulatorio del electrón. En 1926, un físico austriaco, Erwin Schrödinger (1887–1961; Premio Nobel de Física, 1933), desarrolló mecánica de ondas , una técnica matemática que describe la relación entre el movimiento de una partícula que exhibe propiedades onduladas ( como un electrón) y sus energías permitidas.
Aunque la mecánica cuántica utiliza matemáticas sofisticadas, no es necesario que comprenda los detalles matemáticos para seguir nuestra discusión sobre sus conclusiones generales. Nos centramos en las propiedades de las funciones de onda que son las soluciones de las ecuaciones de Schrödinger.
Funciones de onda
Una función de onda (Ψ) es una función matemática que relaciona la ubicación de un electrón en un punto dado en el espacio (identificado por x , y y z [ 19459011] coordenadas) a la amplitud de su onda, que corresponde a su energía. Así, cada función de onda está asociada con una energía particular E . Las propiedades de las funciones de onda derivadas de la mecánica cuántica se resumen aquí:
- Una función de onda usa tres variables para describir la posición de un electrón. Generalmente se requiere una cuarta variable para describir completamente la ubicación de los objetos en movimiento. Tres especifican la posición en el espacio (como con las coordenadas cartesianas x , y y z ), y uno especifica el momento en que el objeto está en el ubicación especificada Por ejemplo, si usted fuera el capitán de un barco tratando de interceptar un submarino enemigo, necesitaría saber su latitud, longitud y profundidad, así como el momento en que iba a estar en esta posición (Figura 6.5. 1) Para los electrones, podemos ignorar la dependencia del tiempo porque usaremos ondas estacionarias, que por definición no cambian con el tiempo, para describir la posición de un electrón.
- La magnitud de la función de onda en un punto particular del espacio es proporcional a la amplitud de la onda en ese punto. Muchas funciones de onda son funciones complejas, que es un término matemático que indica que contienen ( sqrt {-1} ), representado como (i ). Por lo tanto, la amplitud de la onda no tiene un significado físico real. Por el contrario, el signo de la función de onda (ya sea positiva o negativa) corresponde a la fase de la onda, que será importante en nuestra discusión sobre la unión química. El signo de la función de onda no debe confundirse con una carga eléctrica positiva o negativa.
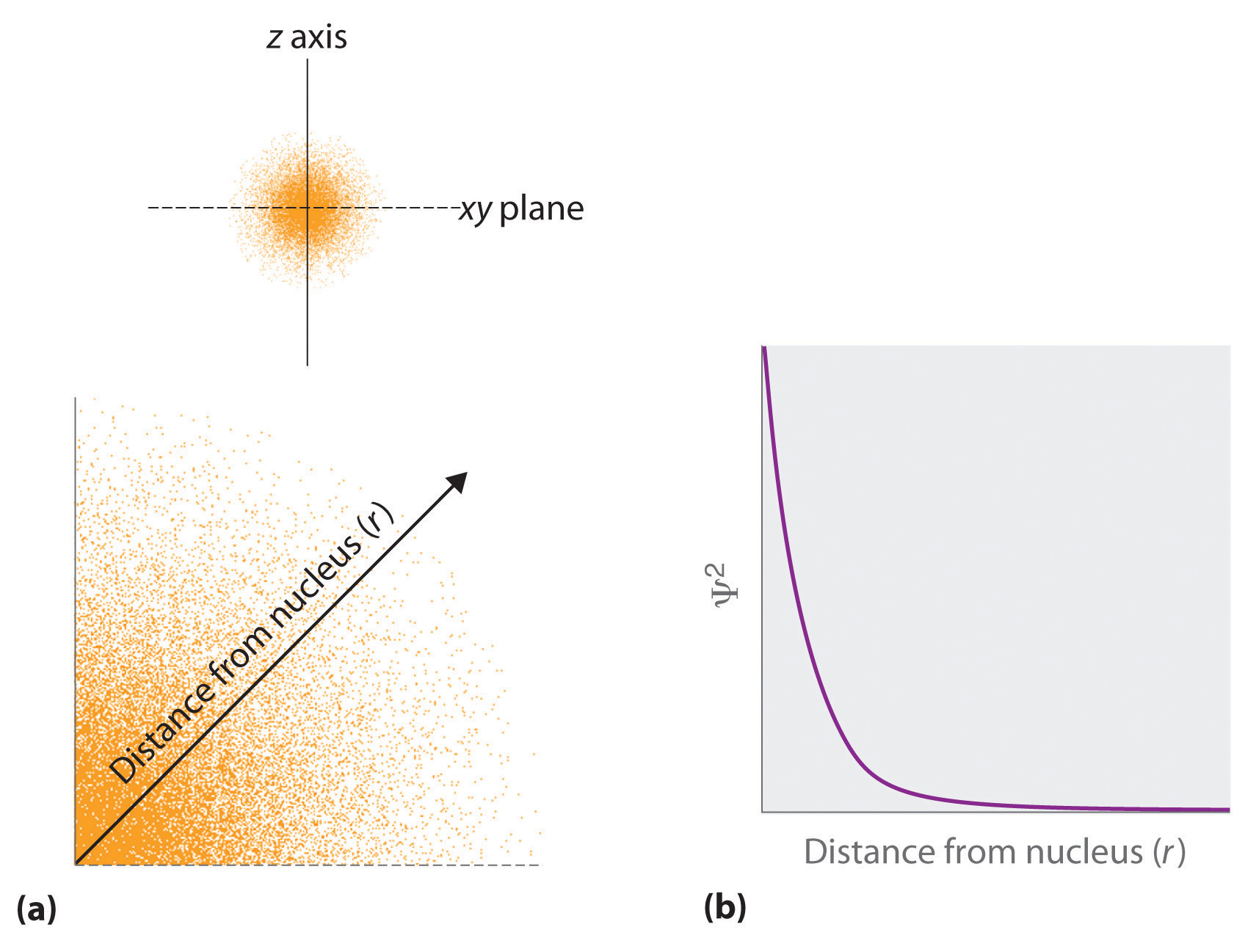
- El cuadrado de la función de onda en un punto dado es proporcional a la probabilidad de encontrar un electrón en ese punto, lo que conduce a una distribución de probabilidades en el espacio. El cuadrado de la función de onda ( ( Psi ^ 2 )) es siempre una cantidad real [recuerde que eso ( sqrt {-1} ^ 2 = -1 )] y es proporcional a la probabilidad de Encontrar un electrón en un punto dado. Más exactamente, la probabilidad viene dada por el producto de la función de onda Ψ y su complejo conjugado Ψ *, en el que todos los términos que contienen i se reemplazan por (- i ). Utilizamos las probabilidades porque, de acuerdo con el principio de incertidumbre de Heisenberg, no podemos especificar con precisión la posición de un electrón. La probabilidad de encontrar un electrón en cualquier punto del espacio depende de varios factores, incluida la distancia desde el núcleo y, en muchos casos, el equivalente atómico de la latitud y la longitud. Como una forma de representar gráficamente la distribución de probabilidad, la probabilidad de encontrar un electrón se indica mediante la densidad de puntos coloreados, como se muestra para el estado fundamental del átomo de hidrógeno en la Figura ( PageIndex {2} ).
- Describir la distribución de electrones como una onda estacionaria conduce a conjuntos de números cuánticos que son característicos de cada función de onda. De los patrones de ondas estacionarias unidimensionales y bidimensionales que se muestran anteriormente , se podría esperar (correctamente) que los patrones de ondas estacionarias tridimensionales serían complejos. Afortunadamente, sin embargo, en el siglo XVIII, un matemático francés, Adrien Legendre (1752-1783), desarrolló un conjunto de ecuaciones para describir el movimiento de las mareas en la superficie de un planeta inundado. Schrödinger incorporó las ecuaciones de Legendre en sus funciones de onda. El requisito de que las ondas deben estar en fase entre sí para evitar la cancelación y producir una onda estacionaria da como resultado un número limitado de soluciones (funciones de onda), cada una de las cuales se especifica mediante un conjunto de números llamados números cuánticos .
- Cada función de onda está asociada con una energía particular. Como en el modelo de Bohr, se cuantifica la energía de un electrón en un átomo; solo puede tener ciertos valores permitidos. La principal diferencia entre el modelo de Bohr y el enfoque de Schrödinger es que Bohr tuvo que imponer la idea de la cuantificación arbitrariamente, mientras que en el enfoque de Schrödinger, la cuantización es una consecuencia natural de describir un electrón como una onda estacionaria.
Números cuánticos
El enfoque de Schrödinger utiliza tres números cuánticos ( n , l y m l ) para especificar cualquier función de onda. Los números cuánticos proporcionan información sobre la distribución espacial de un electrón. Aunque n puede ser cualquier número entero positivo, solo se permiten ciertos valores de l y m l valor dado de n .
El número cuántico principal
El número cuántico principal (n) indica la distancia relativa promedio de un electrón desde el núcleo:
[n = 1, 2, 3, 4,… label {6.5.1} ]
Como n aumenta para un átomo dado, también lo hace la distancia promedio de un electrón desde el núcleo. Un electrón con carga negativa que, en promedio, está más cerca del núcleo con carga positiva es atraído hacia el núcleo con más fuerza que un electrón que está más lejos en el espacio. Esto significa que los electrones con valores más altos de n son más fáciles de eliminar de un átomo. Se dice que todas las funciones de onda que tienen el mismo valor de n constituyen una capa principal porque esos electrones tienen distancias promedio similares desde el núcleo. Como verá, el número cuántico principal n corresponde al n utilizado por Bohr para describir las órbitas de electrones y por Rydberg para describir los niveles de energía atómica.
El número cuántico azimutal
El segundo número cuántico a menudo se llama número cuántico azimutal (l) . El valor de l describe la forma de la región del espacio ocupada por el electrón. Los valores permitidos de l dependen del valor de n y pueden variar de 0 a n – 1:
[l = 0, 1, 2,…, n – 1 etiqueta {6.5.2} ]
Por ejemplo, si n = 1, l puede ser solo 0; si n = 2, l puede ser 0 o 1; Etcétera. Para un átomo dado, todas las funciones de onda que tienen los mismos valores de n y l forman una subshell . Las regiones del espacio ocupadas por electrones en la misma subcapa generalmente tienen la misma forma, pero están orientadas de manera diferente en el espacio.
El número cuántico magnético
El tercer número cuántico es el número cuántico magnético ( (m_l )). El valor de (m_l ) describe la orientación de la región en el espacio ocupado por un electrón con respecto a un campo magnético aplicado. Los valores permitidos de (m_l ) dependen del valor de l : m l puede variar de – l a l en pasos integrales:
[m_l = −l, −l + 1, …, 0, …, l – 1, l label {6.5.3} ]
Por ejemplo, si (l = 0 ), (m_l ) puede ser solo 0; si l = 1, m l puede ser −1, 0 o +1; y si l = 2, m l puede ser −2, −1, 0, +1 o +2.
Cada función de onda con una combinación permitida de n , l y m l describe un valor atómico orbital , una distribución espacial particular para un electrón. Para un conjunto dado de números cuánticos, cada capa principal tiene un número fijo de subcapas, y cada subcapa tiene un número fijo de orbitales.
En lugar de especificar todos los valores de n y l cada vez que nos referimos a un subshell o un orbital, los químicos usan un sistema abreviado con letras minúsculas para denotar el valor de [ 19459010] l para una subshell u orbital particular:
| l = | 0 | 1 | 2 | 3 |
|---|---|---|---|---|
| Designación | s | p | d | f |
El número cuántico principal se nombra primero, seguido de la letra s , p , d o f según corresponda. (Estas designaciones orbitales se derivan de términos históricos para las características espectroscópicas correspondientes: s arpa, p rinciple, d iffuse, y f undamental .) Un orbital 1 s tiene n = 1 y l = 0; un subshell 2 p tiene n = 2 y l = 1 (y tiene tres orbitales 2 p , correspondientes a m l = −1, 0 y +1); un subshell 3 d tiene n = 3 y l = 2 (y tiene cinco orbitales 3 d , correspondientes a m l = −2, −1, 0, +1 y +2); Etcétera.
Podemos resumir las relaciones entre los números cuánticos y el número de subcapas y orbitales de la siguiente manera (Tabla 6.5.1):
- Cada caparazón principal tiene n subcapas. Para n = 1, solo es posible una única subshell (1 s ); para n = 2, hay dos subcapas (2 s y 2 p ); para n = 3, hay tres subcapas (3 s , 3 p y 3 d ); Etcétera. Cada shell tiene una subshell ns , cualquier shell con n ≥ 2 también tiene una subshell np , y cualquier shell con n ≥ 3 también tiene una subshell nd . Debido a que un subshell 2 d requeriría tanto n = 2 como l = 2, que no es un valor permitido de l para [ 19459010] n = 2, un subshell 2 d no existe.
- Cada subshell tiene 2 l + 1 orbitales. Esto significa que todas las subcapas ns contienen un solo orbital s , todas las subcapas np contienen tres orbitales p , todas nd [ 19459011] subcapas contienen cinco orbitales d , y todas las subcapas nf contienen siete orbitales f .
Cada caparazón principal tiene n subcapas, y cada caparazón tiene 2 l + 1 orbitales.
| n | l | Designación de subshell | (m_l ) | Número de orbitales en subshell | Número de orbitales en la carcasa |
|---|---|---|---|---|---|
| 1 | 0 | 1 s | 0 | 1 | 1 |
| 2 | 0 | 2 s | 0 | 1 | 4 |
| 1 | 2 p | −1, 0, 1 | 3 | ||
| 3 | 0 | 3 s | 0 | 1 | 9 |
| 1 | 3 p | −1, 0, 1 | 3 | ||
| 2 | 3 d | −2, −1, 0, 1, 2 | 5 | ||
| 4 | 0 | 4 s | 0 | 1 | 16 |
| 1 | 4 p | −1, 0, 1 | 3 | ||
| 2 | 4 d | −2, −1, 0, 1, 2 | 5 | ||
| 3 | 4 f | −3, −2, −1, 0, 1, 2, 3 | 7 |
Resumen
Existe una relación entre los movimientos de los electrones en los átomos y las moléculas y sus energías que se describe por la mecánica cuántica. Debido a la dualidad onda-partícula, los científicos deben lidiar con la probabilidad de que un electrón se encuentre en un punto particular del espacio. Para hacerlo, se requirió el desarrollo de la mecánica cuántica , que utiliza las funciones de onda (Ψ) para describir la relación matemática entre el movimiento de los electrones en los átomos y las moléculas y sus energías. Las funciones de onda tienen cinco propiedades importantes:
- la función de onda utiliza tres variables (ejes cartesianos x , y y z ) para describir la posición de un electrón;
- la magnitud de la función de onda es proporcional a la intensidad de la onda;
- la probabilidad de encontrar un electrón en un punto dado es proporcional al cuadrado de la función de onda en ese punto, lo que lleva a una distribución de probabilidades en el espacio que a menudo se representa como una gráfica de densidad de electrones ;
- que describe las distribuciones de electrones como ondas estacionarias conduce naturalmente a la existencia de conjuntos de números cuánticos característicos de cada función de onda; y
- cada distribución espacial del electrón descrita por una función de onda con un conjunto dado de números cuánticos tiene una energía particular.
Los números cuánticos proporcionan información importante sobre la energía y la distribución espacial de un electrón. El número cuántico principal n puede ser cualquier número entero positivo; a medida que n aumenta para un átomo, la distancia promedio del electrón al núcleo también aumenta. Todas las funciones de onda con el mismo valor de n constituyen una capa principal en la que los electrones tienen distancias promedio similares al núcleo. El número cuántico azimutal l puede tener valores integrales entre 0 y n – 1; Describe la forma de la distribución de electrones. las funciones de onda que tienen los mismos valores de n y l constituyen una subshell , correspondiente a distribuciones de electrones que generalmente difieren en orientación en lugar de forma o distancia promedio de el núcleo. El número cuántico magnético m l puede tener 2 l + 1 valores integrales, que van desde – [19459010 ] l a + l , y describe la orientación de la distribución de electrones. Cada función de onda con un conjunto dado de valores de n , l y m l describe un espacio particular distribución de un electrón en un átomo, un orbital atómico .