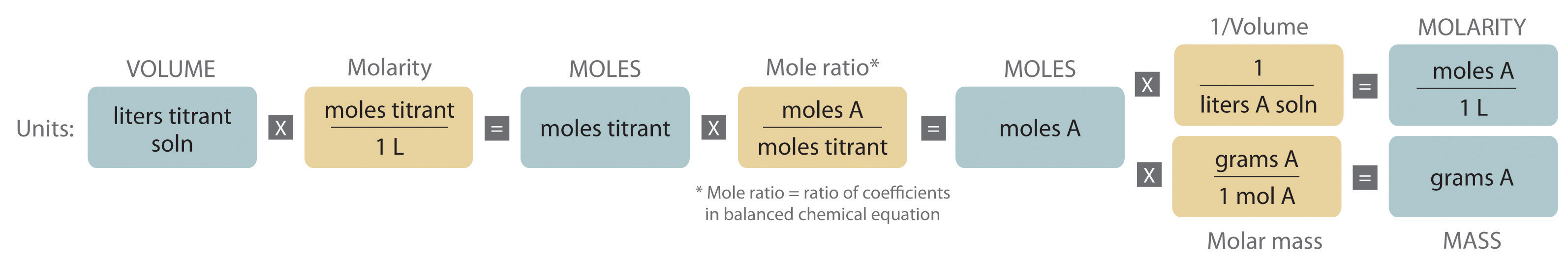
La naturaleza química de las especies presentes en lo desconocido determina qué tipo de reacción es la más apropiada y también cómo determinar el punto de equivalencia. El volumen de titulante agregado, su concentración y los coeficientes de la ecuación química balanceada para la reacción nos permiten calcular el número total de moles de lo desconocido en la solución original. Como hemos medido el volumen de la solución que contiene lo desconocido, podemos calcular la molaridad de la sustancia desconocida. Este procedimiento se resume gráficamente aquí:
Ejemplo ( PageIndex {1} ): permanganato de potasio
La sal de calcio del ácido oxálico [Ca (O 2 CCO 2 )] se encuentra en la savia y las hojas de algunos vegetales, incluidas las espinacas y el ruibarbo, y en muchos ornamentales plantas Debido a que el ácido oxálico y sus sales son tóxicos, cuando un alimento como el ruibarbo se procesa comercialmente, las hojas deben eliminarse y el contenido de oxalato debe controlarse cuidadosamente.
La reacción de MnO 4 – con ácido oxálico (HO 2 CCO 2 H) en solución acuosa ácida produce Mn [ 19459018] 2 + y CO 2 :
( begin {pmatrix}
Debido a que esta reacción es rápida y se completa, el permanganato de potasio (KMnO 4 ) se usa ampliamente como reactivo para determinar la concentración de ácido oxálico.
Suponga que agita una muestra de 10.0 g de ruibarbo enlatado con suficiente diluido H 2 SO 4 (ac) para obtener 127 ml de solución incolora. Debido a que el permanganato agregado se consume rápidamente, la adición de pequeños volúmenes de una solución de KMnO 4 0,0247 M, que tiene un color púrpura intenso, al extracto de ruibarbo no cambia inicialmente el color del extracto. Sin embargo, cuando se añaden 15,4 ml de la solución de permanganato, la solución se vuelve de color púrpura tenue debido a la presencia de un ligero exceso de permanganato. Si suponemos que el ácido oxálico es la única especie en solución que reacciona con el permanganato, ¿qué porcentaje de la masa de la muestra original era oxalato de calcio? El siguiente video muestra la titulación cuando se agregan pequeñas cantidades medidas de una solución de permaganato conocida. En el punto final, la cantidad de moles de permaganato agregado es igual a la cantidad de moles de oxalato en la solución, lo que determina cuántos moles de oxalato comenzamos.
Dado: ecuación, masa de muestra, volumen de solución y molaridad y volumen de titulante
Preguntado por: porcentaje de masa de desconocido en la muestra
Estrategia:
Balancee la ecuación química para la reacción usando estados de oxidación.
Calcule el número de moles de permanganato consumidos multiplicando el volumen del titulador por su molaridad. Luego calcule el número de moles de oxalato en la solución multiplicando por la relación de los coeficientes en la ecuación química balanceada. Debido a que el oxalato de calcio contiene una proporción 1: 1 de Ca 2 + : – O 2 CCO 2 [ 19459018] – , el número de moles de oxalato en la solución es el mismo que el número de moles de oxalato de calcio en la muestra original.
Encuentre la masa de oxalato de calcio multiplicando el número de moles de oxalato de calcio en la muestra por su masa molar. Divida la masa de oxalato de calcio por la masa de la muestra y conviértala en un porcentaje para calcular el porcentaje en masa de oxalato de calcio en la muestra original.
Solución:
A Como en todos los demás problemas de este tipo, el primer requisito es una ecuación química equilibrada para la reacción. El uso de estados de oxidación da
[2MnO_4 ^ – (aq) + 5HO_2CCO_2H (aq) + 6H ^ + (aq) rightarrow 2Mn ^ {2 +} (aq) + 10CO_2 (g) + 8H_2O (l) ]
Así, cada mol de MnO 4 – agregado consume 2,5 mol de ácido oxálico.
B Debido a que conocemos la concentración de permanganato (0.0247 M) y el volumen de solución de permanganato que se necesitaba para consumir todo el ácido oxálico (15.4 mL), podemos calcular la cantidad de moles de MnO 4 – consumido. Para hacer esto, primero convertimos el volumen en ml a un volumen en litros. Luego, simplemente multiplicando la molaridad de la solución por el volumen en litros, encontramos el número de moles de (MnO_4 ^ – )
[15,4 ; cancel {mL} left ( dfrac {1 : cancel {L}} {1000 ; cancel {mL}} right) left ( dfrac {0.0247 ; mol ; MnO_ {4} ^ {-}} {1 ; cancel {L}} right) = 3.80 times 10 ^ {4 ;} mol ; MnO_ {4} ^ {-} ]
El número de moles de ácido oxálico, y por lo tanto oxalato, presente puede calcularse a partir de la relación molar de los reactivos en la ecuación química equilibrada. Podemos abreviar la tabla necesaria para calcular la cantidad de moles de ácido oxálico en
[ begin {align} moles : HO_2 CCO_2 H & = 3 .80 times 10 ^ {- 4} : cancel {mol : MnO_4 ^ -} left ( dfrac {5 : mol : HO_2 CCO_2 H} {2 : cancel {mol : MnO_4 ^ -}} right) \ & = 9 .50 times 10 ^ {- 4} : mol : HO_2 CCO_2 H end {alinear} ]
C El problema pide el porcentaje de oxalato de calcio en masa en la muestra original de 10.0 g de ruibarbo, por lo que necesitamos saber la masa de oxalato de calcio que produjo 9.50 × 10 −4 mol de ácido oxálico. Como el oxalato de calcio es Ca (O 2 CCO 2 ), 1 mol de oxalato de calcio dio 1 mol de ácido oxálico en la extracción de ácido inicial:
[Ca (O_2CCO_2) (s) + 2H ^ + (aq) rightarrow Ca ^ {2 +} (aq) + HO_2CCO_2H (aq) ]
La masa de oxalato de calcio originalmente presente fue
( begin {align} mass : of : CaC_2 O_4 & = 9 .50 times 10 ^ {- 4} : cancel {mol : HO_2 CCO_2 H} left ( dfrac {1 : cancel {mol : CaC_2 O_4}} {1 : cancel {mol : HO_2 CCO_2 H}} right) left ( dfrac {128 .10 : g : CaC_2 O_4} {1 : cancel {mol : CaC_2 O_4}} right) \ & = 0 .122 : g : CaC_2 O_4 end {align} )
La muestra original contenía 0,122 g de oxalato de calcio por 10,0 g de ruibarbo. El porcentaje de oxalato de calcio en masa fue así
[% CaC_2 O_4 = dfrac {0 .122 : g} {10 .0 : g} times 100 = 1 .22 % ]
Debido a que el problema requería el porcentaje en masa de oxalato de calcio en la muestra original en lugar de la concentración de ácido oxálico en el extracto, no necesitamos conocer el volumen de la solución de ácido oxálico para este calculo
Ejercicio ( PageIndex {1} ): Glutatión
El glutatión es un compuesto de bajo peso molecular que se encuentra en las células vivas y que es producido naturalmente por el hígado. Los proveedores de atención médica administran glutatión por vía intravenosa para prevenir los efectos secundarios de la quimioterapia y para prevenir problemas renales después de una cirugía de derivación cardíaca. Su estructura es la siguiente:
El glutatión se encuentra en dos formas: una abreviada como (izquierda) GSH (que indica la presencia de un grupo –SH) y la otra (derecha) como GSSG (la forma disulfuro , en la cual una S –S enlace une dos unidades de glutatión). La forma GSH se oxida fácilmente a GSSG con yodo elemental:
[ ce {2GSH (aq) + I_2 (aq) rightarrow GSSG (aq) + 2HI (aq)}
Se agrega una pequeña cantidad de almidón soluble como indicador. Debido a que el almidón reacciona con el exceso I 2 para dar un color azul intenso, la aparición de un color azul indica que se ha alcanzado el punto de equivalencia de la reacción.
Agregar pequeños volúmenes de una solución acuosa 0.0031 M de I 2 a 194 ml de una solución que contiene glutatión y un rastro de almidón soluble inicialmente no causa ningún cambio. Sin embargo, después de agregar 16.3 ml de solución de yodo, aparece un color azul pálido permanente debido a la formación del complejo de almidón y yodo. ¿Cuál es la concentración de glutatión en la solución original?
Respuesta
5,2 × 10 −4 M