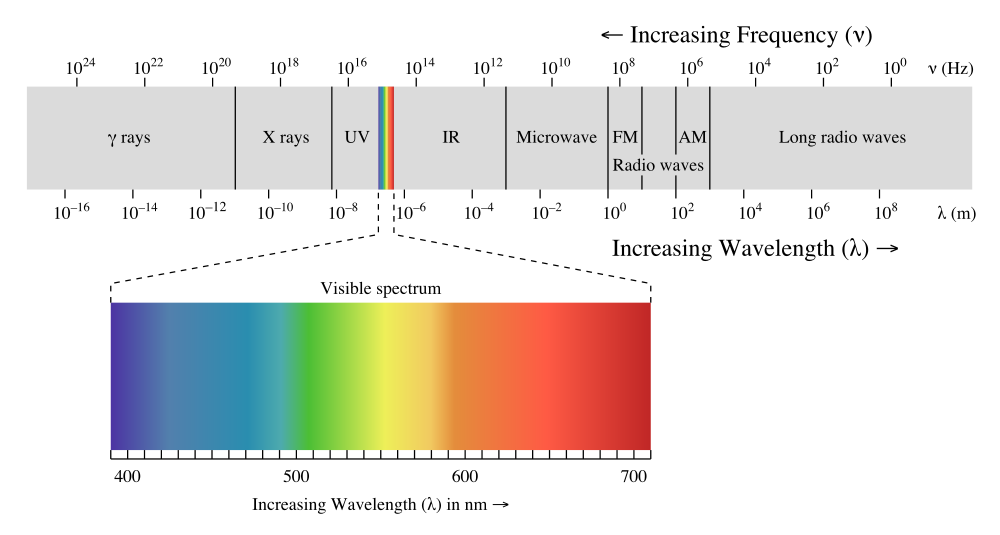
La radiación electromagnética es una forma de energía que se produce por perturbaciones eléctricas y magnéticas oscilantes, o por el movimiento de partículas cargadas eléctricamente que viajan a través de un vacío o materia. La radiación de electrones se libera como fotones, que son haces de energía luminosa que viajan a la velocidad de la luz como ondas armónicas cuantificadas. Esta energía luego se agrupa en categorías basadas en su longitud de onda en el espectro electromagnético y tiene ciertas características, que incluyen amplitud, longitud de onda y frecuencia (Figura ( PageIndex {1} )).
Las propiedades generales de toda radiación electromagnética incluyen:
- La radiación electromagnética puede viajar a través del espacio vacío, mientras que la mayoría de los otros tipos de ondas deben viajar a través de algún tipo de sustancia. Por ejemplo, las ondas de sonido necesitan un gas, un sólido o un líquido para pasar para ser escuchadas.
- La velocidad de la luz ( (c )) es siempre una constante (2.99792458 x 10 8 m s -1 ).
- Las longitudes de onda ( ( lambda )) se miden entre las distancias de crestas o canales.
La energía de un fotón se expresa por la ley de Planck en términos de la frecuencia ( (
u )) del fotón
[E = h
u label {24.5.1} ]
desde ( lambda
u = c ) para toda la luz La ley de Plancks también puede expresarse en términos de la longitud de onda del fotón
[E = h
u = dfrac {hc} { lambda} label {24.5.2} ]
Si la luz blanca pasa a través de un prisma, se divide en todos los colores del arco iris (Figura ( PageIndex {2} )). La luz visible es simplemente una pequeña parte de un espectro electromagnético, la mayoría de los cuales no podemos ver: rayos gamma, rayos X, infrarrojos, ondas de radio, etc. Cada uno de estos tiene una longitud de onda particular, que va desde 10 -16 metros para rayos gamma hasta varios cientos de metros para ondas de radio. La luz visible tiene longitudes de onda de aproximadamente 400 a 750 nm (1 nanómetro = 10 -9 metros).
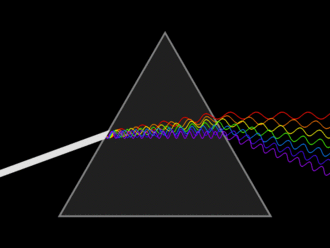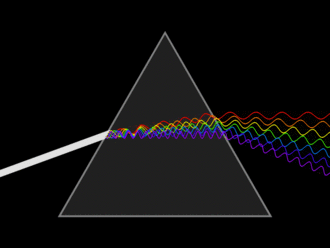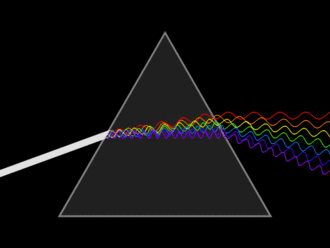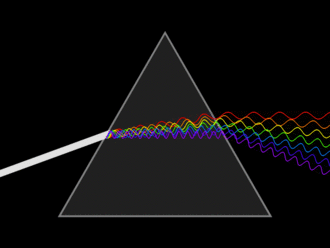
Origen de los colores
El proceso de absorción involucra la excitación de los electrones de valencia en la molécula típicamente desde el nivel más bajo llamado Orbital Molecular Ocupado Más Alto (HOMO) a un estado más alto llamado Orbital Molecular No Ocupado más Bajo ( LUMO [ 19459013]). Cuando esta transición HOMO y LUMO (Figura ( PageIndex {3} )) involucra la absorción de luz visible, la muestra se colorea.
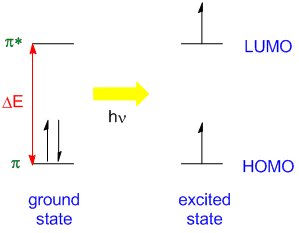
La diferencia de energía HOMO-LUMO
[ Delta E = E_ {HOMO} – E_ {LUMO} label {24.5.3A} ]
depende de la naturaleza de la molécula y se puede conectar a la longitud de onda de la luz absorbida
[ Delta E = h
u = dfrac {hc} { lambda} label {24.5.3B} ]
La ecuación ( ref {24.5.3B} ) es la ecuación más importante en el campo de las interacciones de materia de luz (espectroscopía).
Como demostró el ejemplo ( PageIndex {1} ), cuando la luz blanca atraviesa o es reflejada por una sustancia coloreada, se absorbe una porción característica de las longitudes de onda mixtas. La luz restante asumirá entonces el color complementario a las longitudes de onda absorbidas. Esta relación se demuestra con la rueda de colores que se muestra a continuación. Aquí, los colores complementarios son diametralmente opuestos entre sí (Figura ( PageIndex {5} )). Por lo tanto, la absorción de luz de 420-430 nm hace que la sustancia sea amarilla, y la absorción de luz de 500-520 nm la vuelve roja. El verde es único en el sentido de que puede crearse por absorción cerca de 400 nm, así como por absorción cerca de 800 nm.
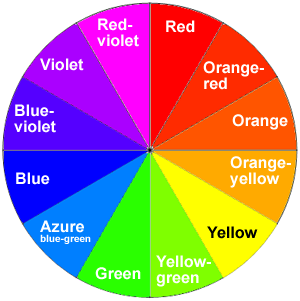
Se dice que los colores directamente opuestos entre sí en la rueda de colores son colores complementarios. Azul y amarillo son colores complementarios; rojo y cian son complementarios; y también lo son el verde y el magenta. Mezclar dos colores complementarios de luz le dará luz blanca. Lo que todo esto significa es que si un color particular es absorbido por la luz blanca, lo que detecta su ojo al mezclar todas las otras longitudes de onda de luz es su color complementario. La solución de sulfato de cobre (II) es azul pálido (cian) porque absorbe la luz en la región roja del espectro y el cian es el color complementario del rojo (Tabla ( PageIndex {1} )).
| Color | Longitud de onda (nm) | ΔE HOMO – LUMO gap (eV) |
|---|---|---|
| UV | 100 – 400 | 12,4 – 3,10 |
| Violeta | 400 – 425 | 3.10 – 2.92 |
| Azul | 425 – 492 | 2.92 – 2.52 |
| Verde | 492 – 575 | 2.52 – 2.15 |
| Amarillo | 575 – 585 | 2,15 – 2,12 |
| Naranja | 585 – 647 | 2.12 – 1.92 |
| Rojo | 647 – 700 | 1.92 – 1.77 |
| IR cercano | 700 – 10,000 | 1.77 – 0.12 |
Si el compuesto absorbe en una región de los espectros, aparece con el color opuesto (complementario), ya que se ha eliminado todo el color absorbido. Por ejemplo:
|
||
El origen del color en iones complejos
A menudo hablamos casualmente sobre los metales de transición como aquellos en el medio de la Tabla Periódica donde se están llenando los orbitales d, pero estos realmente deberían llamarse d elementos de bloque en lugar de elementos de transición (o metales ) La definición de un metal de transición es aquella que forma uno o más iones estables que tienen d orbitales llenos de manera incompleta. El zinc con la estructura electrónica [Ar] 3d 10 4s 2 no cuenta como metal de transición, sea cual sea la definición que utilice. En el metal, tiene un nivel 3d completo. Cuando forma un ion, los electrones 4s se pierden, dejando nuevamente un nivel 3d completamente completo. En el otro extremo de la fila, el escandio ([Ar] 3d 1 4s 2 ) tampoco cuenta realmente como metal de transición. Aunque hay un nivel d parcialmente lleno en el metal, cuando forma su ion, pierde los tres electrones externos. El ion Sc 3 + no cuenta como un ion de metal de transición porque su nivel 3d está vacío.
Entonces, ¿qué causa que los iones de metales de transición absorban las longitudes de onda de la luz visible (causando color) mientras que los iones de metales que no son de transición no lo hacen? ¿Y por qué el color varía tanto de un ion a otro? Esto se discute en las siguientes secciones.
Magnetismo
El momento magnético de un sistema mide la fuerza y la dirección de su magnetismo. El término en sí generalmente se refiere al momento dipolar magnético. Cualquier cosa que sea magnética, como un imán de barra o un circuito de corriente eléctrica, tiene un momento magnético. Un momento magnético es una cantidad vectorial, con una magnitud y una dirección. Un electrón tiene un momento dipolar magnético de electrones, generado por la propiedad de giro intrínseco del electrón, lo que lo convierte en una carga eléctrica en movimiento. Hay muchas formas magnéticas diferentes: incluyendo paramagnetismo y diamagnetismo, ferromagnetismo y anti-ferromagnetismo. Solo los dos primeros se presentan a continuación.
Paramagnetismo
El paramagnetismo se refiere al estado magnético de un átomo con uno o más electrones no apareados. Los electrones no apareados son atraídos por un campo magnético debido a los momentos dipolares magnéticos de los electrones. La regla de Hund establece que los electrones deben ocupar cada orbital individualmente antes de que cualquier orbital esté doblemente ocupado. Esto puede dejar el átomo con muchos electrones no apareados. Debido a que los electrones no apareados pueden girar en cualquier dirección, muestran momentos magnéticos en cualquier dirección. Esta capacidad permite que los átomos paramagnéticos sean atraídos por los campos magnéticos. El oxígeno diatómico, (O_2 ) es un buen ejemplo de paramagnetismo (descrito a través de la teoría de los orbitales moleculares). El siguiente video muestra oxígeno líquido atraído hacia un campo magnético creado por un imán fuerte:
Una demostración química del paramagnetismo del oxígeno, como lo demuestra la atracción del oxígeno líquido hacia un imán. Universidad de Carleton, Ottawa, Canadá.
Como se muestra en el video, el oxígeno molecular ( (O_2 ) es paramagnético y es atraído por el imán. En contraste , el nitrógeno molecular, (N_2 ), sin embargo, no tiene electrones no apareados y es diamagnético (este concepto se analiza más adelante), por lo tanto, no se ve afectado por el imán.
Hay algunas excepciones a la regla del paramagnetismo ; Estos se refieren a algunos metales de transición, en los que el electrón no apareado no está en un orbital d. Los ejemplos de estos metales incluyen (Sc ^ {3 +} ), (Ti ^ {4 +} ), (Zn ^ {2 +} ) y (Cu ^ + ). Estos metales no se definen como paramagnéticos: se consideran diamagnéticos porque todos los electrones d están emparejados. Los compuestos paramagnéticos a veces muestran propiedades magnéticas a granel debido al agrupamiento de los átomos metálicos. Este fenómeno se conoce como ferromagnetismo, pero esta propiedad no se discute aquí.
Diamagnetismo
Las sustancias diamagnéticas se caracterizan por electrones emparejados, excepto en el caso de metales de transición discutido anteriormente, no hay electrones no emparejados. Según el Pauli Principio de exclusión que establece que no hay dos electrones idénticos que puedan tomar el mismo estado cuántico al mismo tiempo, los espines de electrones están orientados en direcciones opuestas. Esto hace que los campos magnéticos de los electrones se cancelen; por lo tanto, no hay un momento magnético neto, y el átomo no puede ser atraído hacia un campo magnético. De hecho, las sustancias diamagnéticas son débilmente repelidas por un campo magnético. De hecho, las sustancias diamagnéticas son débilmente repelidas por un campo magnético como se demuestra con la hoja de carbono pirolítico en la Figura ( PageIndex {6} ).

Figura ( PageIndex {6} ): Levitando carbono pirolítico: una pequeña (~ 6 mm ) pieza de pirolítico grafito levitando sobre un conjunto de imanes de neodimio permanente ([ 19459011] cubos de 5 mm en una pieza de acero). Tenga en cuenta que los polos de los imanes están alineados verticalmente y alternados (dos con el norte hacia arriba y dos con el sur hacia arriba, en diagonal). Imagen utilizada con permiso de Wikipedia.
Ejemplo 2: Átomos de zinc
Paso 1: encontrar la configuración electrónica
Para los átomos de Zn, la configuración electrónica es 4s 2 3d 10
Paso 2: Dibuja los orbitales de valencia
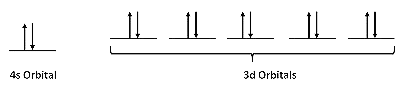
Paso 3: busca electrones no apareados
No hay electrones no apareados.
Paso 4: Determine si la sustancia es paramagnética o diamagnética
Debido a que no hay electrones no apareados, los átomos de Zn son diamagnéticos.
Referencias
- Pettrucci, Ralph H. Química general: principios y aplicaciones modernas. Noveno. Upper Saddle River: Pearson Prentice Hall, 2007
- Sherman, Alan, Sharon J. Sherman y Leonard Russikoff. Conceptos básicos de química Quinta edición. Boston, MA: Houghton Mifflin Company, 1992. Impresión.