Los elementos del grupo 14 muestran un mayor rango de comportamiento químico que cualquier otra familia en la tabla periódica. Tres de los cinco elementos (carbono, estaño y plomo) se conocen desde la antigüedad. Por ejemplo, algunos de los escritos más antiguos conocidos son jeroglíficos egipcios escritos en papiro con tinta hecha de negro de lámpara, un hollín de carbono finamente dividido producido por la combustión incompleta de hidrocarburos (Figura ( PageIndex {1} )). El carbón activado es una forma de carbono aún más finamente dividida que se produce a partir de la descomposición térmica de materiales orgánicos, como el aserrín. Debido a que adsorbe muchos compuestos orgánicos y que contienen azufre, el carbón activado se utiliza para decolorar los alimentos, como el azúcar, y para purificar gases y aguas residuales.
Preparación y propiedades generales del carbono
El carbono elemental, por ejemplo, ocupa el puesto 17 en la lista de componentes de la corteza terrestre. El grafito puro se obtiene haciendo reaccionar el coque, una forma amorfa de carbono utilizada como reductor en la producción de acero, con sílice para dar carburo de silicio (SiC). Esto se descompone térmicamente a temperaturas muy altas (2700 ° C) para dar grafito:
[ mathrm {SiO_2 (s)} + mathrm {3C (s)} xrightarrow { Delta} mathrm {SiC (s)} + mathrm {2CO (g)} label { ( PageIndex {1} )} ]
[ mathrm {SiC (s)} xrightarrow { Delta} mathrm {Si (s)} + mathrm {C (grafito)} label { ( PageIndex {2} )} ]
Un alótropo de carbono, el diamante, es metaestable en condiciones normales, con un ΔG ° f de 2,9 kJ / mol versus grafito. Sin embargo, a presiones superiores a 50,000 atm, la estructura del diamante se ve favorecida y es la forma más estable de carbono. Debido a que la estructura del diamante es más compacta que la del grafito, su densidad es significativamente mayor (3.51 g / cm 3 versus 2.2 g / cm 3 ). Debido a su alta conductividad térmica, el polvo de diamante se utiliza para transferir calor en dispositivos electrónicos.
Las fuentes más comunes de diamantes en la Tierra son las antiguas tuberías volcánicas que contienen una roca llamada kimberlita, una lava que se solidificó rápidamente desde las profundidades de la Tierra. Sin embargo, la mayoría de las formaciones de kimberlita son mucho más nuevas que los diamantes que contienen. De hecho, las cantidades relativas de diferentes isótopos de carbono en el diamante muestran que el diamante es un “fósil” químico y geológico más antiguo que nuestro sistema solar, lo que significa que los diamantes en la Tierra son anteriores a la existencia de nuestro sol. Por lo tanto, los diamantes probablemente se crearon en el interior de la Tierra a partir de granos primordiales de grafito presentes cuando se formó la Tierra (Figura ( PageIndex {2} )). Los diamantes de calidad gema ahora se pueden producir sintéticamente y tienen características químicas, ópticas y físicas idénticas a las de los diamantes naturales de más alto grado.

Reacciones y compuestos de carbono
El carbono es el componente básico de todos los compuestos orgánicos, incluidas las biomoléculas, los combustibles, los productos farmacéuticos y los plásticos, mientras que los compuestos inorgánicos de carbono incluyen los carbonatos metálicos, que se encuentran en sustancias tan diversas como fertilizantes y tabletas antiácidas, haluros, óxidos, carburos. y carboranos. Al igual que el boro en el grupo 13, la química del carbono difiere lo suficiente de la de sus congéneres más pesados para merecer una discusión por separado.
Las estructuras de los alótropos de carbono —diamante, grafito, fullerenos y nanotubos— son distintos, pero todos contienen enlaces simples de pares de electrones. Aunque originalmente se creía que los fullerenos eran una nueva forma de carbono que solo podía prepararse en el laboratorio, se han encontrado fullerenos en ciertos tipos de meteoritos. Otro posible alótropo de carbono también se ha detectado en fragmentos de impacto de un meteorito rico en carbono; parece consistir en largas cadenas de átomos de carbono unidas por enlaces alternos simples y triples, (–C≡C – C≡C–) n . Los nanotubos de carbono (“buckytubes”) se están estudiando como bloques de construcción potenciales para detectores de ultramicroscala y computadoras moleculares y como correas para estaciones espaciales. Actualmente se utilizan en dispositivos electrónicos, como las puntas conductoras de las pistolas de electrones en miniatura para pantallas planas en computadoras portátiles.
Aunque se conocen todos los tetrahaluros de carbono (CX 4 ), generalmente no se obtienen por reacción directa del carbono con los halógenos elementales (X 2 ) sino por métodos indirectos como la siguiente reacción, donde X es Cl o Br:
[CH_ {4 (g)} + 4X_ {2 (g)} rightarrow CX_ {4 (l, s)} + 4HX _ {(g)} label { ( PageIndex {7} ) } ]
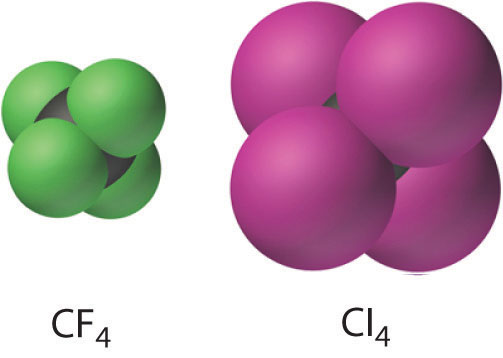
Todos los tetrahaluros de carbono tienen la geometría tetraédrica pronosticada por el modelo de repulsión de pares de electrones (VSEPR) de valencia, como se muestra para CCl 4 y CI 4 . Su estabilidad disminuye rápidamente a medida que el halógeno aumenta de tamaño debido a la superposición orbital deficiente y al aumento de la aglomeración. Debido a que el enlace C – F es aproximadamente un 25% más fuerte que un enlace C – H, los fluorocarbonos son térmica y químicamente más estables que los hidrocarburos correspondientes, a la vez que tienen un carácter hidrofóbico similar. Un polímero de tetrafluoroetileno (F 2 C = CF 2 ), análogo al polietileno, es el revestimiento de teflón antiadherente que se encuentra en muchas sartenes de cocción, y compuestos similares se utilizan para hacer que las telas sean resistentes a las manchas. (como Scotch-Gard) o impermeable pero transpirable (como Gore-Tex).
La estabilidad de los tetrahaluros de carbono disminuye con el aumento del tamaño del halógeno debido a la superposición orbital cada vez más pobre y al hacinamiento.
El carbono reacciona con el oxígeno para formar CO o CO 2 , dependiendo de la estequiometría. El monóxido de carbono es un gas incoloro, inodoro y venenoso que reacciona con el hierro en la hemoglobina para formar una unidad de Fe-CO, que evita que la hemoglobina se una, transporte y libere oxígeno en la sangre (ver Figura 23.26). En el laboratorio, el monóxido de carbono se puede preparar a pequeña escala deshidratando ácido fórmico con ácido sulfúrico concentrado:
[ mathrm {HCO_2H (l)} xrightarrow { mathrm {H_2SO_4 (l)}} mathrm {CO (g)} + mathrm {H_3O ^ + (aq)} + mathrm {HSO ^ -_4} label { ( PageIndex {8} )} ]
El monóxido de carbono también reacciona con los halógenos para formar los oxohaluros (COX 2 ). Probablemente el más conocido de estos es el fosgeno (Cl 2 C = O), que es altamente venenoso y se utilizó como arma química durante la Primera Guerra Mundial:
[ mathrm {CO (g)} + mathrm {Cl_2 (g)} xrightarrow { Delta} textrm {Cl} _2 textrm {C = O (g)} label { ( Índice de página {9} )} ]
A pesar de su toxicidad, el fosgeno es un químico industrial importante que se prepara a gran escala, principalmente en la fabricación de poliuretanos.
El dióxido de carbono se puede preparar a pequeña escala haciendo reaccionar casi cualquier sal de carbonato o bicarbonato metálico con un ácido fuerte. Como es típico de un óxido no metálico, CO 2 reacciona con agua para formar soluciones ácidas que contienen ácido carbónico (H 2 CO 3 ). A diferencia de sus reacciones con el oxígeno, la reacción de carbono con azufre a altas temperaturas produce solo disulfuro de carbono (CS 2 ):
[ mathrm {C (s)} + mathrm {2S (g)} xrightarrow { Delta} mathrm {CS_2 (g)} label { ( PageIndex {1} ) 0} ]
También se conoce el análogo de selenio CSe 2 . Ambos tienen la estructura lineal predicha por el modelo VSEPR, y ambos tienen un olor vil (y en el caso de CSe 2 , altamente tóxico), líquidos volátiles. Los análogos de azufre y selenio del monóxido de carbono, CS y CSe, son inestables porque los enlaces C≡Y (Y es S o Se) son mucho más débiles que el enlace C≡O debido a una superposición orbital π más pobre.
Los enlaces ( pi ) entre el carbono y los calcogenuros más pesados son débiles debido a una mala superposición orbital.
Los compuestos binarios de carbono con menos elementos electronegativos se denominan carburos. Las propiedades químicas y físicas de los carburos dependen en gran medida de la identidad del segundo elemento, dando como resultado tres clases generales: carburos iónicos, carburos intersticiales y carburos covalentes. La reacción del carbono a altas temperaturas con metales electropositivos como los de los grupos 1 y 2 y el aluminio produce carburos iónicos, que contienen cationes metálicos discretos y aniones de carbono. La identidad de los aniones depende del tamaño del segundo elemento. Por ejemplo, elementos más pequeños, como el berilio y el aluminio, proporcionan meturos como Be 2 C y Al 4 C 3 , que contienen formalmente el C 4 – ion derivado del metano (CH 4 ) al perder los cuatro átomos de H como protones. En contraste, los metales más grandes como el sodio y el calcio dan carburos con estequiometrías de Na 2 C 2 y CaC 2 . Debido a que estos carburos contienen el ion C 4− , que se deriva del acetileno (HC≡CH) al perder ambos átomos de H como protones, se denominan acetilides más adecuadamente. La reacción de los carburos iónicos con ácido acuoso diluido da como resultado la protonación de los aniones para dar los hidrocarburos originales: CH 4 o C 2 H 2 . Durante muchos años, las lámparas de los mineros utilizaron la reacción del carburo de calcio con agua para producir un suministro constante de acetileno, que se encendió para proporcionar una linterna portátil.

La reacción del carbono con la mayoría de los metales de transición a altas temperaturas produce carburos intersticiales. Debido a la naturaleza menos electropositiva de los metales de transición, estos carburos contienen interacciones covalentes de metal-carbono, lo que da como resultado diferentes propiedades: la mayoría de los carburos intersticiales son buenos conductores de electricidad, tienen altos puntos de fusión y se encuentran entre las sustancias más duras conocidas. Los carburos intersticiales exhiben una variedad de composiciones nominales, y a menudo son compuestos no estequiométricos cuyo contenido de carbono puede variar en un amplio rango. Entre los más importantes están el carburo de tungsteno (WC), que se utiliza industrialmente en herramientas de corte de alta velocidad, y la cementita (Fe 3 C), que es un componente principal del acero.
Los elementos con una electronegatividad similar a la del carbono forman carburos covalentes, como el carburo de silicio (SiC; Ecuación ( ref {Eq1} )) y el carburo de boro (B 4 C). Estas sustancias son extremadamente duras, tienen altos puntos de fusión y son químicamente inertes. Por ejemplo, el carburo de silicio es altamente resistente al ataque químico a temperaturas tan altas como 1600 ° C. Debido a que también mantiene su resistencia a altas temperaturas, el carburo de silicio se utiliza en elementos de calentamiento para hornos eléctricos y en resistencias de temperatura variable.
Los carburos formados a partir de los elementos del grupo 1 y 2 son iónicos. Los metales de transición forman carburos intersticiales con interacciones covalentes de metal y carbono, y los carburos covalentes son químicamente inertes.