Aunque la mayoría de los elementos conocidos tienen al menos un isótopo cuyo núcleo atómico es estable indefinidamente, todos los elementos tienen isótopos que son inestables y se desintegran, o se descomponen, a tasas mensurables mediante la emisión de radiación. Algunos elementos no tienen isótopos estables y eventualmente se descomponen en otros elementos. A diferencia de las reacciones químicas que fueron el foco principal de capítulos anteriores y se deben a cambios en la disposición de los electrones de valencia de los átomos, el proceso de desintegración nuclear produce cambios dentro de un núcleo atómico. Comenzamos nuestra discusión sobre las reacciones nucleares revisando las convenciones utilizadas para describir los componentes del núcleo.
El núcleo atómico
Cada elemento puede ser representado por la notación (^ A_Z textrm X ), donde A , el número de masa, es la suma del número de protones y el número de neutrones, y [ 19459006] Z , el número atómico, es el número de protones. Los protones y neutrones que forman el núcleo de un átomo se llaman nucleones , y un átomo con un número particular de protones y neutrones se llama nucleido . Los nucleidos con el mismo número de protones pero diferentes números de neutrones se llaman isótopos . Los isótopos también se pueden representar mediante una notación alternativa que utiliza el nombre del elemento seguido del número de masa, como el carbono-12. Los isótopos estables de oxígeno, por ejemplo, se pueden representar de cualquiera de las siguientes maneras:
| (^ A_Z textrm X ) | ( ce {^ {16} _8 O} ) | ( ce {^ {17} _8 O} ) | ( ce {^ {18} _8 O} ) |
| (^ A textrm X ) | ( ce {^ {16} O} ) | ( ce {^ {17} O} ) | ( ce {^ {18} O} ) |
| ( textrm {elemento-A:} ) | ( textrm {oxígeno-16} ) | ( textrm {oxygen-17} ) | ( textrm {oxígeno-18} ) |
Debido a que el número de neutrones es igual a A – Z , vemos que el primer isótopo de oxígeno tiene 8 neutrones, el segundo isótopo 9 neutrones y el tercer isótopo 10 neutrones Los isótopos de todos los elementos naturales en la Tierra están presentes en proporciones casi fijas, y cada proporción constituye la abundancia natural de un isótopo . Por ejemplo, en una muestra terrestre típica de oxígeno, el 99.76% de los átomos de O es oxígeno-16, el 0.20% es oxígeno-18 y el 0.04% es oxígeno-17. Se dice que cualquier núcleo que es inestable y se descompone espontáneamente es radiactivo , emitiendo partículas subatómicas y radiación electromagnética. Las emisiones se denominan colectivamente radiactividad y se pueden medir. Los isótopos que emiten radiación se denominan radioisótopos .
Estabilidad nuclear
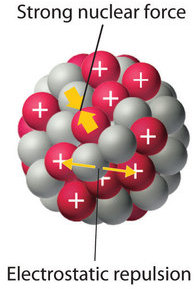
El núcleo de un átomo ocupa una pequeña fracción del volumen de un átomo y contiene el número de protones y neutrones que es característico de un isótopo dado. Las repulsiones electrostáticas normalmente causarían que los protones cargados positivamente se repelen entre sí, pero el núcleo no se separa debido a la fuerza nuclear , una fuerza atractiva extremadamente potente pero de muy corto alcance entre los nucleones ( Figura ( PageIndex {1} ) ). Todos los núcleos estables, excepto el núcleo de hidrógeno-1 ( 1 H) contienen al menos un neutrón para superar la repulsión electrostática entre protones. A medida que aumenta el número de protones en el núcleo, el número de neutrones necesarios para un núcleo estable aumenta aún más rápidamente. Demasiados protones (o muy pocos neutrones) en el núcleo dan como resultado un desequilibrio entre las fuerzas, lo que conduce a la inestabilidad nuclear.
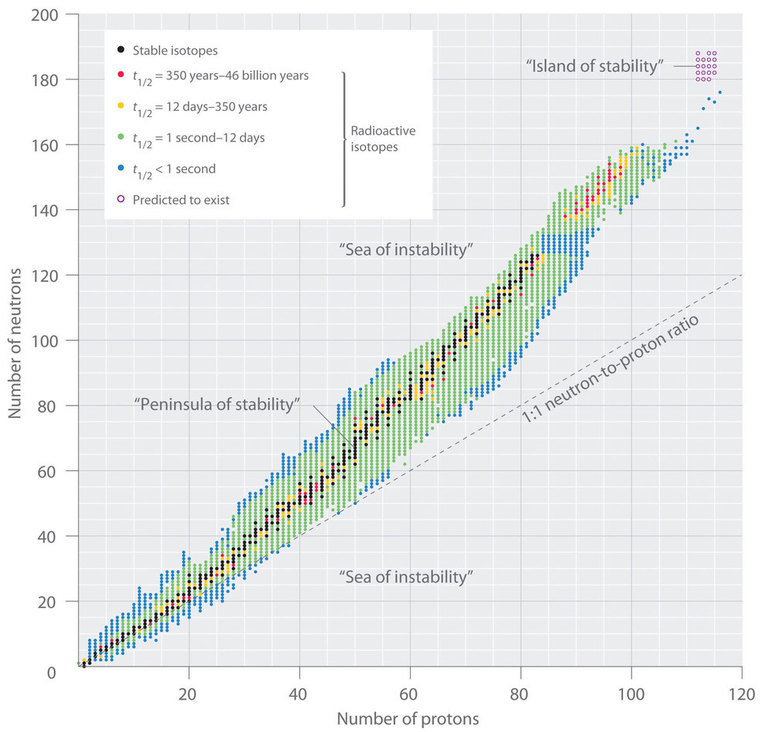
La relación entre el número de protones y el número de neutrones en núcleos estables, definidos arbitrariamente como que tienen una vida media mayor de 10 veces la edad de la Tierra, se muestra gráficamente en Figura ( PageIndex {2 } ) . Los isótopos estables forman una “península de estabilidad” en un “mar de inestabilidad”. Solo dos isótopos estables, 1 H y 3 Él, tienen una relación de neutrones a protones menor que 1. Varios isótopos estables de átomos de luz tienen una relación de neutrones a protones igual a 1 (p. ej., (^ 4_2 textrm {He} ), (^ {10} _5 textrm {B} ) y (^ {40} _ {20} textrm {Ca} ) ) Todos los demás núcleos estables tienen una relación más alta de neutrones a protones, que aumenta constantemente a aproximadamente 1.5 para los núcleos más pesados. Sin embargo, independientemente del número de neutrones, todos los elementos con Z> 83 son inestables y radiactivos.
Como se muestra en Figura ( PageIndex {3} ) , más de la mitad de los núcleos estables (166 de 279) tienen incluso números de neutrones y protones ; solo 6 de los 279 núcleos estables no tienen números impares de ambos. Además, ciertos números de neutrones o protones dan como resultado núcleos especialmente estables; estos son los llamados números mágicos 2, 8, 20, 50, 82 y 126. Por ejemplo, el estaño ( Z = 50) tiene 10 isótopos estables, pero los elementos a cada lado del estaño en la tabla periódica, el indio ( Z = 49) y el antimonio ( Z = 51), tienen solo 2 isótopos estables cada uno. Se dice que los núcleos con números mágicos de tanto protones como neutrones son “doblemente mágicos” y son aún más estables. Ejemplos de elementos con núcleos doblemente mágicos son (^ 4_2 textrm {He} ), con 2 protones y 2 neutrones, y (^ {208} _ {82} textrm {Pb} ), con 82 protones y 126 neutrones, que es el isótopo estable más pesado conocido de cualquier elemento.
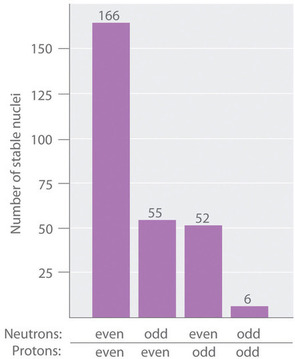
Los núcleos más estables contienen incluso números de neutrones y protones
El patrón de estabilidad sugerido por los números mágicos de nucleones recuerda la estabilidad asociada con las configuraciones electrónicas de capa cerrada de los gases nobles en el grupo 18 y ha llevado a la hipótesis de que el núcleo contiene capas de nucleones que están en de alguna manera análoga a las capas ocupadas por electrones en un átomo. Como se muestra en Figura ( PageIndex {2} ) , la “península” de isótopos estables está rodeada por un “arrecife” de isótopos radiactivos, que son lo suficientemente estables como para existir durante períodos de tiempo variables antes finalmente se descomponen para producir otros núcleos.