El modelo nuclear del átomo de Rutherford ayudó a explicar por qué los átomos de diferentes elementos exhiben un comportamiento químico diferente. La identidad de un elemento se define por su número atómico (Z) , el número de protones en el núcleo de un átomo del elemento. El número atómico es, por lo tanto, diferente para cada elemento. Los elementos conocidos se organizan en orden de aumento de Z en la tabla periódica ( Figura ( PageIndex {1} ) ). La justificación del formato peculiar de la tabla periódica se explica más adelante. E a cada elemento se le asigna un símbolo único de una, dos o tres letras. Los nombres de los elementos se enumeran en la tabla periódica, junto con sus símbolos, números atómicos y masas atómicas. La química de cada elemento está determinada por su número de protones y electrones. En un átomo neutro, el número de electrones es igual al número de protones.
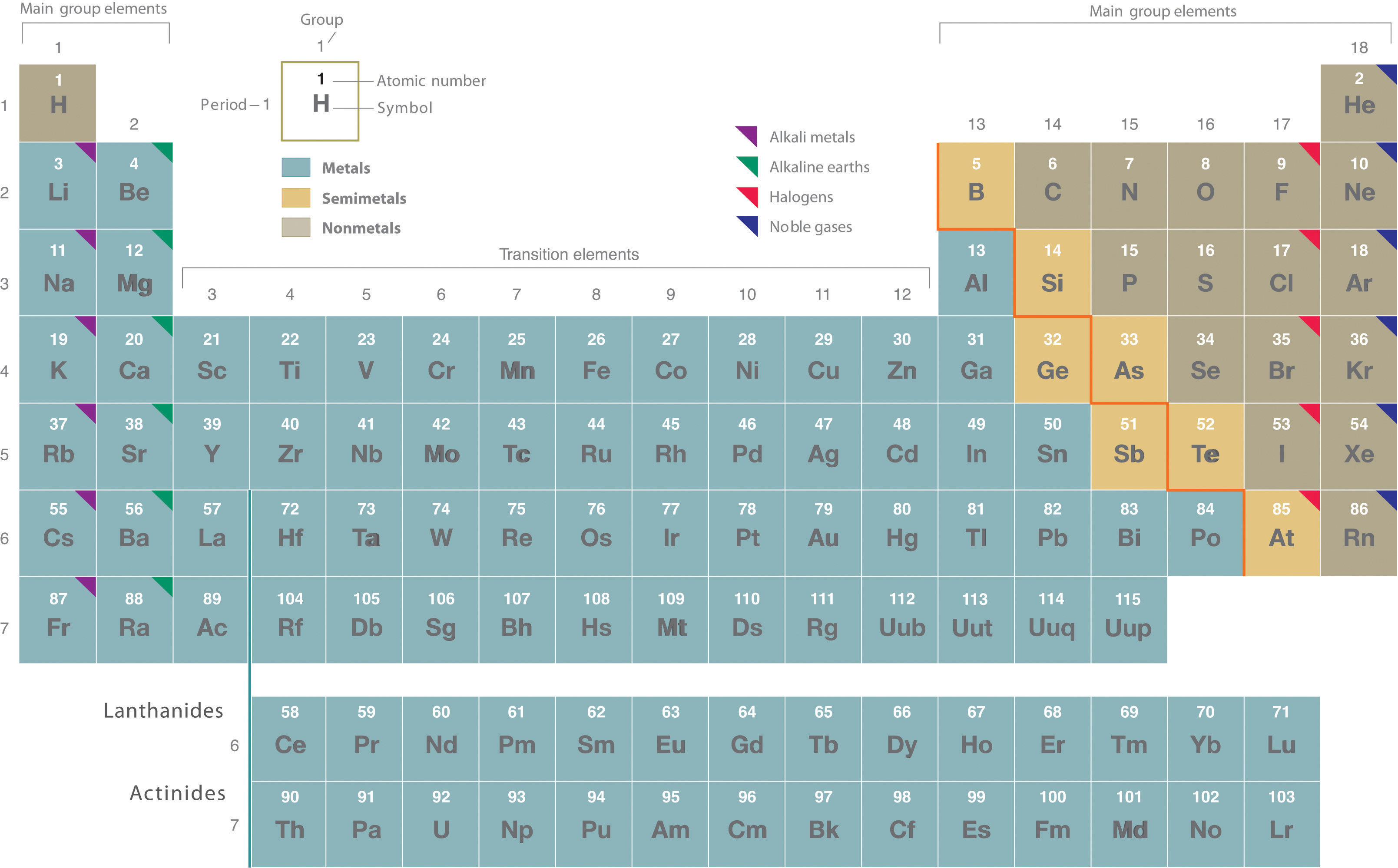
Los elementos se organizan en una tabla periódica , que es probablemente la ayuda de aprendizaje más importante en química. Resume grandes cantidades de información sobre los elementos de una manera que facilita la predicción de muchas de sus propiedades y reacciones químicas. Los elementos están dispuestos en siete filas horizontales, en orden creciente de número atómico de izquierda a derecha y de arriba a abajo. Las filas se llaman períodos y están numeradas del 1 al 7. Los elementos se apilan de tal manera que los elementos con propiedades químicas similares forman columnas verticales, llamadas grupos, numerados del 1 al 18 (las tablas periódicas más antiguas usan un sistema basado en números romanos). Los grupos 1, 2 y 13-18 son los elementos principales del grupo, listados como A en las tablas anteriores. Los grupos 3–12 están en el medio de la tabla periódica y son los elementos de transición, listados como B en las tablas más antiguas. Las dos filas de 14 elementos en la parte inferior de la tabla periódica son los lantánidos y los actínidos, cuyas posiciones en la tabla periódica se indican en el grupo 3.
Metales, no metales y semimetales
La línea naranja en zigzag que corre en diagonal desde la parte superior izquierda a la inferior derecha a través de los grupos 13–16 en Figura ( PageIndex {1} ) divide los elementos en metales (en azul, debajo y a la izquierda de la línea) y no metales (en bronce, arriba y a la derecha de la línea). Los elementos de color dorado que se encuentran a lo largo de la línea diagonal exhiben propiedades intermedias entre metales y no metales; Se llaman semimetales.
La distinción entre metales y no metales es una de las más fundamentales en química. Los metales, como el cobre o el oro, son buenos conductores de electricidad y calor; se pueden tirar de los cables porque son dúctiles; se pueden martillar o prensar en láminas o láminas delgadas porque son maleables; y la mayoría tiene una apariencia brillante, por lo que son brillantes. La gran mayoría de los elementos conocidos son metales. De los metales, solo el mercurio es un líquido a temperatura y presión ambiente; Todo lo demás son sólidos.
Los no metales, en contraste, son generalmente malos conductores de calor y electricidad y no son brillantes. Los no metales pueden ser gases (como el cloro), líquidos (como el bromo) o sólidos (como el yodo) a temperatura y presión ambiente. La mayoría de los no metales sólidos son frágiles, por lo que se rompen en pedazos pequeños cuando se golpean con un martillo o se tiran de un alambre. Como se esperaba, los semimetales exhiben propiedades intermedias entre metales y no metales.
Como se señaló anteriormente, la tabla periódica se organiza de manera que los elementos con comportamientos químicos similares estén en el mismo grupo. Los químicos a menudo hacen declaraciones generales sobre las propiedades de los elementos en un grupo usando nombres descriptivos con orígenes históricos. Por ejemplo, los elementos del Grupo 1 se conocen como metales alcalinos, el Grupo 2 son los metales alcalinotérreos, el Grupo 17 son los halógenos y el Grupo 18 son los gases nobles.
Grupo 1: Los metales alcalinos
Los metales alcalinos son litio, sodio, potasio, rubidio, cesio y francio. El hidrógeno es único porque generalmente se coloca en el Grupo 1, pero no es un metal. Los compuestos de los metales alcalinos son comunes en la naturaleza y en la vida diaria. Un ejemplo es la sal de mesa (cloruro de sodio); Los compuestos de litio se usan en grasas, en baterías y como medicamentos para tratar a pacientes que exhiben un comportamiento maníaco-depresivo o bipolar. Aunque el litio, el rubidio y el cesio son de naturaleza relativamente rara, y el francio es tan inestable y altamente radiactivo que existe en pequeñas cantidades, el sodio y el potasio son los elementos séptimo y octavo más abundantes en la corteza terrestre, respectivamente.
Grupo 2: Los metales alcalinotérreos
Los metales alcalinotérreos son berilio, magnesio, calcio, estroncio, bario y radio. El berilio, el estroncio y el bario son raros, y el radio es inestable y altamente radiactivo. En contraste, el calcio y el magnesio son los elementos quinto y sexto más abundantes en la Tierra, respectivamente; Se encuentran en enormes depósitos de piedra caliza y otros minerales.
Grupo 17: Los halógenos
Los halógenos son flúor, cloro, bromo, yodo y astatina. El nombre halógeno se deriva de las palabras griegas para “formación de sal”, que refleja que todos los halógenos reaccionan fácilmente con los metales para formar compuestos, como el cloruro de sodio y el cloruro de calcio (utilizado en algunas áreas como sal de carretera).
Los compuestos que contienen el ion fluoruro se agregan a la pasta de dientes y al suministro de agua para prevenir las caries dentales. El flúor también se encuentra en recubrimientos de teflón en utensilios de cocina. Aunque se cree que los propulsores y refrigerantes de clorofluorocarbono conducen al agotamiento de la capa de ozono de la Tierra y contienen tanto flúor como cloro, este último es responsable del efecto adverso en la capa de ozono. El bromo y el yodo son menos abundantes que el cloro, y la astatina es tan radiactiva que solo existe en cantidades insignificantes en la naturaleza.
Grupo 18: Los gases nobles
Los gases nobles son helio, neón, argón, criptón, xenón y radón. Debido a que los gases nobles se componen de átomos únicos, se denominan monoatómicos. A temperatura y presión ambiente, son gases no reactivos. Debido a su falta de reactividad, durante muchos años se les llamó gases inertes o gases raros. Sin embargo, los primeros compuestos químicos que contienen gases nobles se prepararon en 1962. Aunque los gases nobles son componentes relativamente menores de la atmósfera, el gas natural contiene cantidades sustanciales de helio. Debido a su baja reactividad, el argón se usa a menudo como una atmósfera no reactiva (inerte) para soldar y en bombillas. La luz roja emitida por el neón en un tubo de descarga de gas se usa en las luces de neón.
Los gases nobles no reaccionan a temperatura y presión ambiente.
Resumen
La tabla periódica se utiliza como herramienta predictiva. Organiza los elementos en orden creciente de número atómico. Los elementos que exhiben una química similar aparecen en columnas verticales llamadas grupos (numerados del 1 al 18 de izquierda a derecha); Las siete filas horizontales se llaman períodos. Algunos de los grupos tienen nombres comunes ampliamente utilizados, incluidos los metales alcalinos (Grupo 1) y los metales alcalinotérreos (Grupo 2) en el extremo izquierdo, y los halógenos (Grupo 17) y los gases nobles (Grupo 18) en el más a la derecha. Los elementos se pueden dividir ampliamente en metales, no metales y semimetales. Los semimetales exhiben propiedades intermedias entre las de metales y no metales. Los metales se encuentran a la izquierda de la tabla periódica, y los no metales se encuentran en la parte superior derecha. Están separados por una banda diagonal de semimetales. Los metales son lustrosos, buenos conductores de electricidad, y se forman fácilmente (son dúctiles y maleables), mientras que los no metales sólidos son generalmente conductores eléctricos frágiles y pobres. Otros grupos importantes de elementos en la tabla periódica son los elementos principales del grupo, los metales de transición, los lantánidos y los actínidos.