Mucho antes de finales del siglo XIX, era bien sabido que aplicar un alto voltaje a un gas contenido a baja presión en un tubo sellado (llamado tubo de descarga de gas) hacía que la electricidad fluyera a través del gas, que luego emitía light (Figura ( PageIndex {1} )). Los investigadores que intentaban comprender este fenómeno descubrieron que también se emitía una forma inusual de energía desde el cátodo o electrodo con carga negativa; Esta forma de energía se llamaba un rayo catódico.
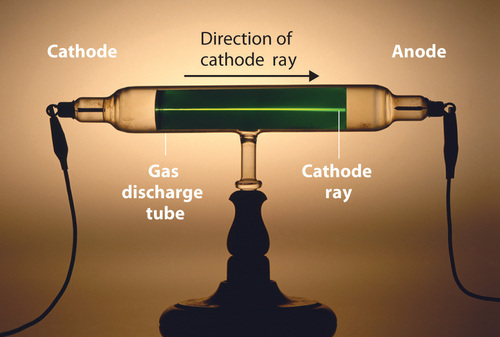
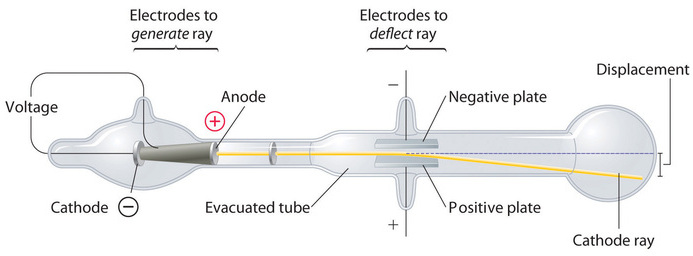
En 1897, el físico británico J. J. Thomson (1856-1940) demostró que los átomos no eran la forma más básica de la materia. Él demostró que los rayos catódicos podían ser desviados o doblados por campos magnéticos o eléctricos, lo que indicaba que los rayos catódicos consisten en partículas cargadas (Figura ( PageIndex {2} )). Más importante aún, midiendo la extensión de la desviación de los rayos catódicos en campos magnéticos o eléctricos de varias fuerzas, Thomson pudo calcular la relación masa-carga de las partículas. Estas partículas fueron emitidas por el cátodo cargado negativamente y repelidas por el terminal negativo de un campo eléctrico. Debido a que las cargas similares se repelen entre sí y las cargas opuestas se atraen, Thomson concluyó que las partículas tenían una carga negativa neta; Estas partículas ahora se llaman electrones. Más relevante para el campo de la química, Thomson descubrió que la relación masa-carga de los rayos catódicos es independiente de la naturaleza de los electrodos metálicos o del gas, lo que sugiere que los electrones son componentes fundamentales de todos los átomos.
Posteriormente, el científico estadounidense Robert Millikan (1868–1953) llevó a cabo una serie de experimentos utilizando gotas de aceite cargadas eléctricamente, que le permitieron calcular la carga en un solo electrón. Con esta información y la relación masa-carga de Thomson, Millikan determinó la masa de un electrón:
[ dfrac {mass} {charge} times {charge} = {mass} ]
Fue en este punto que dos líneas separadas de investigación comenzaron a converger, ambas destinadas a determinar cómo y por qué la materia emite energía. El siguiente video muestra cómo JJ Thompson usó dicho tubo para medir la relación de carga sobre la masa de un electrón
Medición de e / m para un electrón. Video del Davidson College que demuestra el experimento e / m de Thompson.
Radiactividad
La segunda línea de investigación comenzó en 1896, cuando el físico francés Henri Becquerel (1852-1908) descubrió que ciertos minerales, como las sales de uranio, emitían una nueva forma de energía. El trabajo de Becquerel fue ampliado en gran medida por Marie Curie (1867–1934) y su esposo, Pierre (1854–1906); los tres compartieron el Premio Nobel de Física en 1903. Marie Curie acuñó el término radioactividad (del latín radio , que significa “rayo”) para describir la emisión de rayos de energía por la materia. Encontró que un mineral de uranio en particular, el pitchblende, era sustancialmente más radiactivo que la mayoría, lo que sugiere que contenía una o más impurezas altamente radiactivas. Comenzando con varias toneladas de pitchblende, los Curies aislaron dos nuevos elementos radiactivos después de meses de trabajo: el polonio, que recibió su nombre de la Polonia natal de Marie, y el radio, que recibió su nombre por su intensa radiactividad. Pierre Curie llevaba un vial de radio en el bolsillo de su abrigo para demostrar su brillo verdoso, un hábito que lo enfermó por envenenamiento por radiación mucho antes de ser atropellado por un carro tirado por caballos y muerto instantáneamente en 1906. Marie Curie, en A su vez, murió de lo que casi con seguridad era envenenamiento por radiación.

Sobre la base del trabajo de los Curies, el físico británico Ernest Rutherford (1871–1937) realizó experimentos decisivos que condujeron a la visión moderna de la estructura del átomo. Mientras trabajaba en el laboratorio de Thomson poco después de que Thomson descubriera el electrón, Rutherford demostró que los compuestos de uranio y otros elementos emitían al menos dos tipos distintos de radiación. Uno fue fácilmente absorbido por la materia y parecía consistir en partículas que tenían una carga positiva y eran masivas en comparación con los electrones. Debido a que fue el primer tipo de radiación que se descubrió, Rutherford llamó a estas sustancias partículas α. Rutherford también mostró que las partículas en el segundo tipo de radiación, las partículas β, tenían la misma carga y relación de masa a carga que los electrones de Thomson; ahora se sabe que son electrones de alta velocidad. Un tercer tipo de radiación, los rayos γ, se descubrió algo más tarde y se encontró que era similar a la forma de radiación de menor energía llamada rayos X, que ahora se usa para producir imágenes de huesos y dientes.
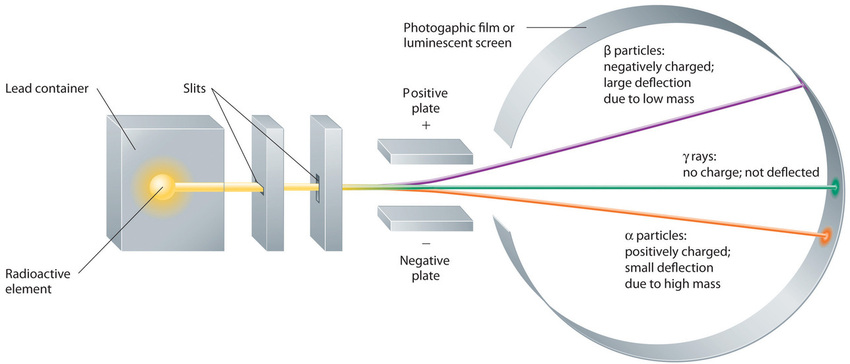
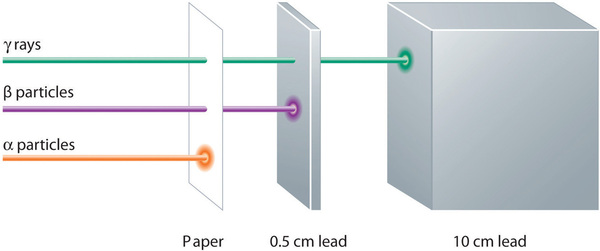
Estos tres tipos de radiación (partículas α, partículas β y rayos γ) se distinguen fácilmente por la forma en que son desviados por un campo eléctrico y por el grado en que penetran la materia. Como ilustra la Figura ( PageIndex {3} ), las partículas α y las partículas β se desvían en direcciones opuestas; Las partículas α se desvían en un grado mucho menor debido a su mayor relación masa-carga. En contraste, los rayos γ no tienen carga, por lo que no son desviados por campos eléctricos o magnéticos. La figura ( PageIndex {5} ) muestra que las partículas α tienen el menor poder de penetración y son detenidas por una hoja de papel, mientras que las partículas β pueden pasar a través de láminas delgadas de metal pero son absorbidas por una lámina de plomo o incluso un vidrio grueso. En contraste, los rayos γ pueden penetrar fácilmente la materia; Se necesitan bloques gruesos de plomo u hormigón para detenerlos.
El modelo atómico
Una vez que los científicos concluyeron que toda la materia contiene electrones cargados negativamente, quedó claro que los átomos, que son eléctricamente neutros, también deben contener cargas positivas para equilibrar los negativos. Thomson propuso que los electrones se incrustaran en una esfera uniforme que contuviera tanto la carga positiva como la mayor parte de la masa del átomo, de forma muy parecida a las pasas de uva o las chispas de chocolate en una galleta (Figura ( PageIndex {6} )) .
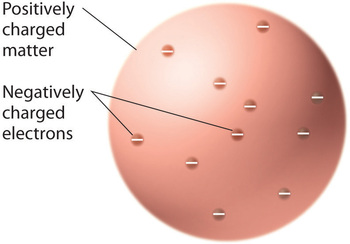
Sin embargo, en un solo experimento famoso, Rutherford mostró inequívocamente que el modelo del átomo de Thomson era incorrecto. Rutherford apuntó una corriente de partículas α a un objetivo de lámina de oro muy delgado (Figura ( PageIndex {7a} )) y examinó cómo las partículas α fueron dispersadas por la lámina. Se eligió el oro porque se podía martillar fácilmente en láminas extremadamente delgadas, minimizando el número de átomos en el objetivo. Si el modelo del átomo de Thomson fuera correcto, las partículas α cargadas positivamente deberían atravesar la masa uniformemente distribuida del objetivo de oro como balas de cañón a través del costado de una casa de madera. Puede que se muevan un poco más despacio cuando emergen, pero deberían pasar esencialmente directamente a través del objetivo (Figura ( PageIndex {7b} )). Para sorpresa de Rutherford, una pequeña fracción de las partículas α se desvió en ángulos grandes, y algunas se reflejaron directamente en la fuente (Figura ( PageIndex {7c} )). Según Rutherford, “fue casi tan increíble como si dispararas un proyectil de 15 pulgadas contra un trozo de papel de seda y volviera y te golpeara”.
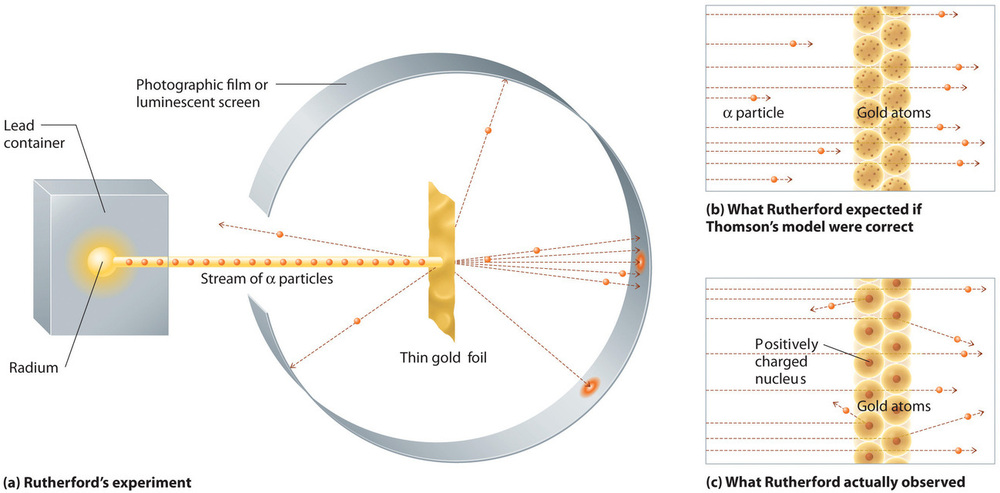
Los resultados de Rutherford no fueron consistentes con un modelo en el que la masa y la carga positiva se distribuyen uniformemente en todo el volumen de un átomo. En cambio, sugirieron fuertemente que tanto la masa como la carga positiva se concentran en una pequeña fracción del volumen de un átomo, que Rutherford llamó el núcleo. Tenía sentido que una pequeña fracción de las partículas α colisionara con los núcleos densos y cargados positivamente, ya sea de forma deslumbrante, lo que resulta en grandes desviaciones o casi de frente, lo que hace que se reflejen directamente en la fuente.
Aunque Rutherford no pudo explicar por qué las repulsiones entre las cargas positivas en los núcleos que contenían más de una carga positiva no causaron la desintegración del núcleo, razonó que las repulsiones entre electrones cargados negativamente causarían que los electrones se distribuyan uniformemente en todo el átomo. volumen. Hoy se sabe que las fuerzas nucleares fuertes, que son mucho más fuertes que las interacciones electrostáticas, mantienen unidos los protones y los neutrones en el núcleo. Por esta y otras ideas, Rutherford recibió el Premio Nobel de Química en 1908. Desafortunadamente, Rutherford hubiera preferido recibir el Premio Nobel de Física porque consideraba que la física era superior a la química. En su opinión, “toda ciencia es física o coleccionar sellos”.
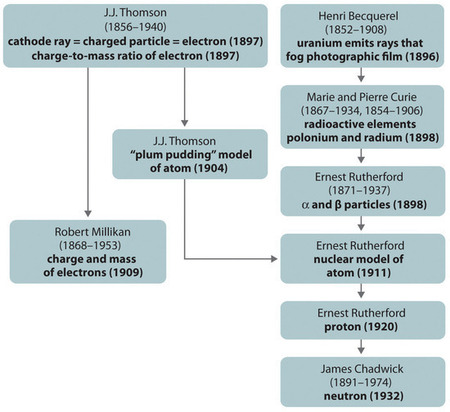
El desarrollo histórico de los diferentes modelos de la estructura del átomo se resume en la Figura ( PageIndex {8} ). Rutherford estableció que el núcleo del átomo de hidrógeno era una partícula cargada positivamente, por lo que acuñó el nombre de protón en 1920. También sugirió que los núcleos de elementos distintos al hidrógeno deben contener partículas eléctricamente neutras con aproximadamente la misma masa que el protón. Sin embargo, el neutrón no se descubrió hasta 1932, cuando James Chadwick (1891-1974, estudiante de Rutherford; Premio Nobel de Física, 1935) lo descubrió. Como resultado del trabajo de Rutherford, quedó claro que una partícula α contiene dos protones y neutrones y, por lo tanto, es el núcleo de un átomo de helio.
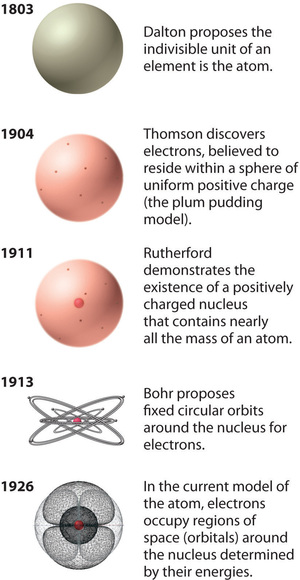
El modelo del átomo de Rutherford es esencialmente el mismo que el modelo moderno, excepto que ahora se sabe que los electrones no están distribuidos uniformemente en todo el volumen de un átomo. En cambio, se distribuyen de acuerdo con un conjunto de principios descritos por Quantum Mechanics. La Figura ( PageIndex {9} ) muestra cómo el modelo del átomo ha evolucionado con el tiempo desde la unidad indivisible de Dalton hasta la visión moderna que se enseña hoy.
Resumen
Los átomos son los bloques de construcción definitivos de toda la materia. La teoría atómica moderna establece los conceptos de los átomos y cómo componen la materia. Los átomos, las partículas más pequeñas de un elemento que exhiben las propiedades de ese elemento, consisten en electrones cargados negativamente alrededor de un núcleo central compuesto de protones masivamente cargados positivamente y neutrones eléctricamente neutros. La radiactividad es la emisión de partículas energéticas y rayos (radiación) por algunas sustancias. Tres tipos importantes de radiación son partículas α (núcleos de helio), partículas β (electrones que viajan a alta velocidad) y rayos γ (similares a los rayos X pero con mayor energía).