Como se discutió anteriormente, la segunda ley de la termodinámica argumenta que todos los procesos deben aumentar la entropía total del universo. Sin embargo, el universo si a menudo se separa en el Sistema y los Alrededores, se pueden observar diferentes cambios de entropía desde la perspectiva del nivel del sistema. Muchos procesos dan como resultado un aumento en la entropía del sistema ( Delta S> 0 ):
- Aumentar el volumen que puede ocupar un gas aumentará el desorden de un gas
- Disolver un soluto en una solución aumentará la entropía del soluto, lo que generalmente resulta en un aumento en la entropía del sistema. (Nota: la solvatación de un soluto a veces puede resultar en una disminución significativa en la entropía disolvente – lo que lleva a una disminución neta en entropía del sistema )
- Los cambios de fase de sólido a líquido, o de líquido a gas, conducen a un aumento en la entropía del sistema
Algunos procesos resultan en una disminución en la entropía de un sistema ( Delta S <0 ):
- Una molécula de gas disuelta en un líquido está mucho más confinada por las moléculas vecinas que cuando está en estado gaseoso. Por lo tanto, la entropía de la molécula de gas disminuirá cuando se disuelva en un líquido
- Un cambio de fase de un líquido a un sólido (es decir, congelación), o de un gas a un líquido (es decir, condensación) da como resultado una disminución en el trastorno de la sustancia y disminución de la entropía
- Una reacción química entre las moléculas de gas que resulta en una disminución neta en el número total de moléculas de gas disminuirá el trastorno del sistema, y resultar en una disminución en la entropía
[2NO _ {(g)} + O_ {2 (g)} rightarrow 2NO_ {2 (g)} ; ; ; Delta S <0 label {19.3.1} ]
¿Cuál es la base molecular de las observaciones anteriores para el cambio en la entropía? Consideremos primero el último ejemplo, la disminución de la entropía asociada con una disminución en el número de moléculas de gas para una reacción química
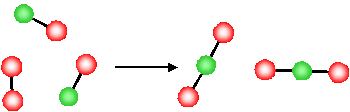
El producto de esta reacción ( (NO_2 )) implica la formación de un nuevo enlace NO y los átomos de O, originalmente en una molécula (O_2 ) separada, ahora están conectado a la molécula (NO ) a través de un nuevo enlace (NO ).
- Dado que ahora están físicamente unidos a la otra molécula (formando una molécula nueva, más grande y única), los átomos O tienen menos libertad para moverse
- La reacción ha resultado en una pérdida de libertad de los átomos (átomos de O)
- Hay una reducción en el desorden del sistema (es decir, debido a la reducción en los grados de libertad, el sistema está más ordenado después de la reacción). ( Delta S <0 ).
Grados moleculares de libertad
Los átomos, moléculas o iones que componen un sistema químico pueden sufrir varios tipos de movimiento molecular, incluida la traducción, rotación y vibración (Figura ( PageIndex {2} )).
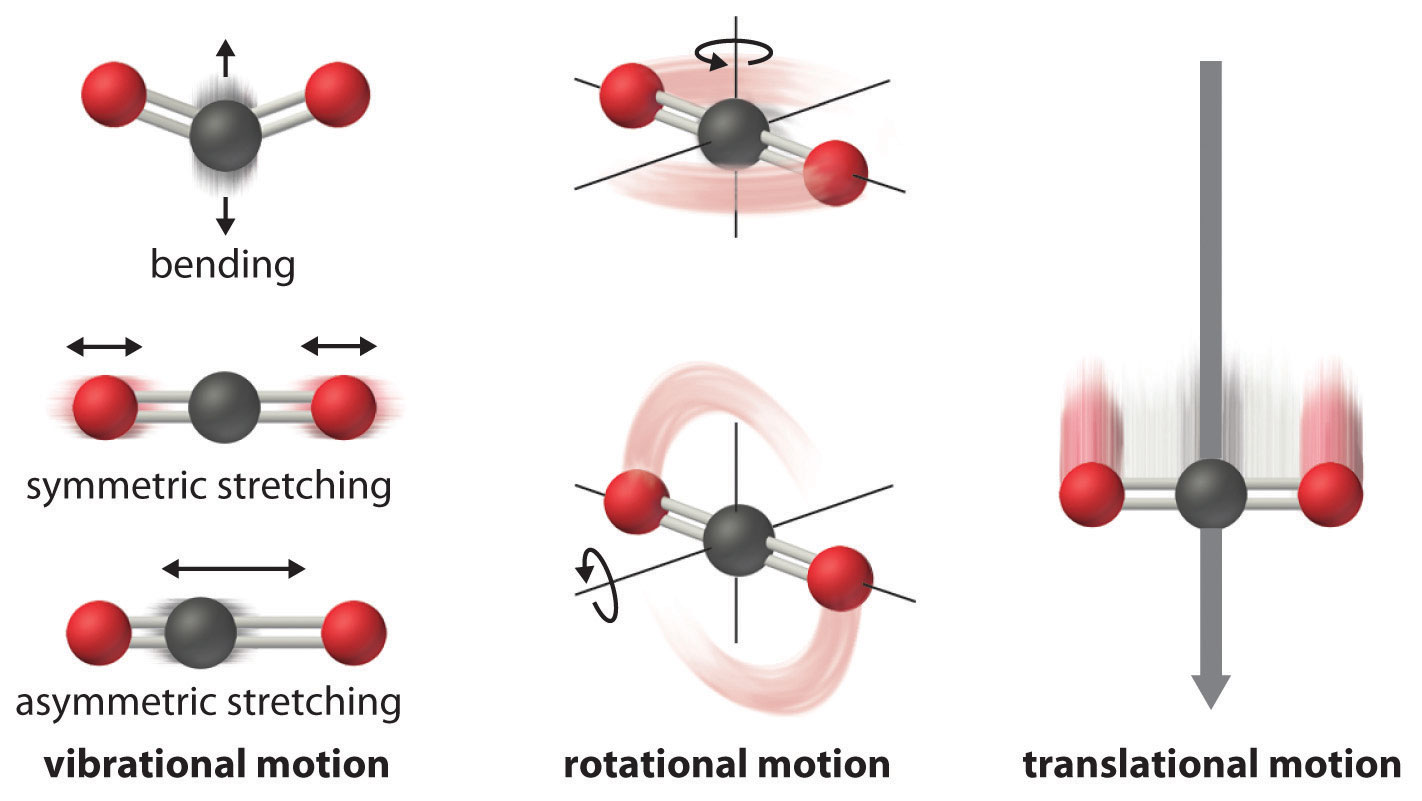
- Movimiento traslacional . La molécula completa puede moverse en alguna dirección en tres dimensiones
- Movimiento rotacional . La molécula completa puede girar alrededor de cualquier eje (aunque en realidad no cambie su posición traslacionalmente )
- Movimiento vibratorio . Los átomos dentro de una molécula tienen cierta libertad de movimiento entre sí; Este desplazamiento puede ser un movimiento periódico como la vibración de un diapasón
La Tercera Ley de Termodinámica
Estas formas de movimiento son formas en que la molécula puede almacenar energía. Cuanto mayor es el movimiento molecular de un sistema, mayor es el número de microestados posibles y mayor es la entropía. Un sistema perfectamente ordenado con un solo microestado disponible tendría una entropía de cero. El único sistema que cumple este criterio es un cristal perfecto a una temperatura de cero absoluto (0 K), en el que cada átomo, molécula o ion componente se fija en su lugar dentro de una red cristalina y no muestra movimiento (ignorando los efectos cuánticos). Tal estado de orden perfecto (o, por el contrario, desorden cero) corresponde a entropía cero. En la práctica, el cero absoluto es una temperatura ideal que no se puede obtener, y un cristal único perfecto también es un ideal que no se puede lograr. No obstante, la combinación de estos dos ideales constituye la base de la tercera ley de la termodinámica : la entropía de cualquier sustancia cristalina perfectamente ordenada en cero absoluto es cero.
Dado que S = 0 corresponde a orden perfecto . La posición de los átomos o moléculas en el cristal estaría perfectamente definida
- A medida que aumenta la temperatura, aumenta la entropía de los átomos en la red
- Los movimientos vibratorios hacen que los átomos y las moléculas en la red estén menos ordenados
La tercera ley de la termodinámica tiene dos consecuencias importantes: define el signo de la entropía de cualquier sustancia a temperaturas superiores al cero absoluto como positivo, y proporciona un punto de referencia fijo que nos permite medir la entropía absoluta de cualquier sustancia en cualquier temperatura. En la práctica, los químicos determinan la entropía absoluta de una sustancia midiendo la capacidad de calor molar (C p ) en función de la temperatura y luego graficando la cantidad C p / T versus T. El área bajo la curva entre 0 K y cualquier temperatura T es la entropía absoluta de la sustancia en T. En contraste, otras propiedades termodinámicas, como la energía interna y la entalpía, pueden evaluarse solo en términos relativos, no en términos absolutos. . En esta sección, examinamos dos formas diferentes de calcular ΔS para una reacción o un cambio físico. El primero, basado en la definición de entropía absoluta proporcionada por la tercera ley de la termodinámica, utiliza valores tabulados de entropías absolutas de sustancias. El segundo, basado en el hecho de que la entropía es una función de estado, utiliza un ciclo termodinámico similar a los discutidos anteriormente.
Calentamiento continuo de un enrejado sólido
Una forma de calcular ΔS para una reacción es usar valores tabulados de la entropía molar estándar (S °), que es la entropía de 1 mol de una sustancia a una temperatura estándar de 298 K; las unidades de S ° son J / (mol · K). A diferencia de la entalpía o la energía interna, es posible obtener valores de entropía absolutos midiendo el cambio de entropía que ocurre entre el punto de referencia de 0 K [correspondiente a S = 0 J / (mol · K)] y 298 K.
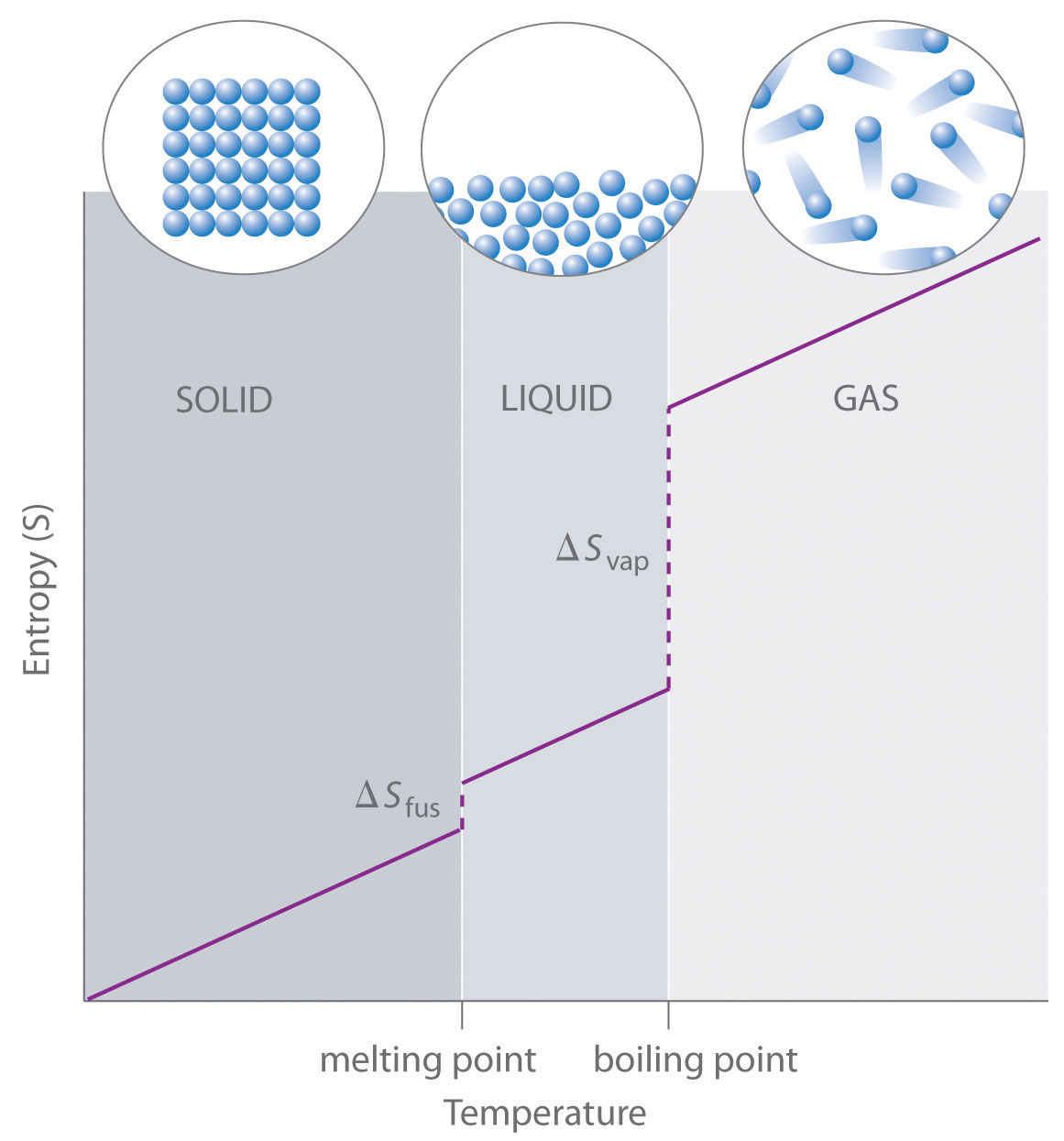
Como se muestra en la Tabla ( PageIndex {1} ), para sustancias con aproximadamente la misma masa molar y número de átomos, los valores de S ° caen en el orden S ° (gas)> S ° (líquido)> S ° (sólido). Por ejemplo, S ° para agua líquida es 70.0 J / (mol · K), mientras que S ° para vapor de agua es 188.8 J / (mol · K). Asimismo, S ° es 260.7 J / (mol · K) para I gaseoso 2 y 116.1 J / (mol · K) para I2 sólido. Este orden tiene un sentido cualitativo basado en los tipos y extensiones de movimiento disponibles para los átomos y las moléculas en las tres fases. La correlación entre el estado físico y la entropía absoluta se ilustra en la Figura ( PageIndex {2} ), que es un gráfico generalizado de la entropía de una sustancia frente a la temperatura.
| Gases | Líquidos | Sólidos | |||
|---|---|---|---|---|---|
| Sustancia | S ° [J / (mol · K)] | Sustancia | S ° [J / (mol · K)] | Sustancia | S ° [J / (mol · K)] |
| Él | 126,2 | H 2 O | 70,0 | C (diamante) | 2,4 |
| H 2 | 130,7 | CH 3 OH | 126,8 | C (grafito) | 5,7 |
| Ne | 146,3 | Br 2 | 152,2 | LiF | 35,7 |
| Ar | 154,8 | CH 3 CH 2 OH | 160,7 | SiO 2 (cuarzo) | 41,5 |
| Kr | 164,1 | C 6 H 6 | 173,4 | Ca | 41,6 |
| Xe | 169,7 | CH 3 COCl | 200,8 | Na | 51,3 |
| H 2 O | 188,8 | C 6 H 12 (ciclohexano) | 204,4 | MgF 2 | 57,2 |
| N 2 | 191,6 | C 8 H 18 (isooctano) | 329,3 | K | 64,7 |
| O 2 | 205,2 | NaCl | 72,1 | ||
| CO 2 | 213,8 | KCl | 82,6 | ||
| I 2 | 260,7 | I 2 | 116,1 | ||
Un examen más detallado de la Tabla ( PageIndex {1} ) también revela que las sustancias con estructuras moleculares similares tienden a tener valores de S ° similares. Entre los materiales cristalinos, aquellos con las entropías más bajas tienden a ser cristales rígidos compuestos de átomos pequeños unidos por enlaces fuertes y altamente direccionales, como el diamante [S ° = 2.4 J / (mol · K)]. En contraste, el grafito, el alótropo de carbono más blando y menos rígido, tiene un S ° más alto [5.7 J / (mol · K)] debido a un mayor desorden en el cristal. Las sustancias cristalinas blandas y aquellas con átomos más grandes tienden a tener entropías más altas debido al aumento del movimiento molecular y el desorden. De manera similar, la entropía absoluta de una sustancia tiende a aumentar a medida que aumenta la complejidad molecular porque el número de microestados disponibles aumenta con la complejidad molecular. Por ejemplo, compare los valores de S ° para CH 3 OH (l) y CH 3 CH 2 OH (l). Finalmente, las sustancias con fuertes enlaces de hidrógeno tienen valores más bajos de S °, lo que refleja una estructura más ordenada.
Resumen
En general, se espera que la entropía aumente para los siguientes tipos de procesos:
- La fusión de un sólido para formar un líquido
- La vaporización de un líquido (o sólido) para producir un gas
- Reacciones químicas que implican cambios de fase de ( text {solid} rightarrow text {liquid / gas} ), o ( text {liquid} rightarrow text {gas} )
- Reacciones químicas que resultan en un aumento en el número de moléculas gaseosas
- Cada vez que aumenta la temperatura de una sustancia