Los tampones son soluciones que mantienen un pH relativamente constante cuando se agrega un ácido o una base. Por lo tanto, protegen o “tamponan” otras moléculas en solución de los efectos del ácido o la base añadidos. Los tampones contienen un ácido débil ( (HA )) y su base conjugada ((A ^ – )) o una base débil ( (B )) y su ácido conjugado ( (BH ^ + )) , y son críticamente importantes para el buen funcionamiento de los sistemas biológicos. De hecho, cada fluido biológico está tamponado para mantener su pH fisiológico.
El efecto iónico común con ácidos y bases
Para comprender cómo funcionan los tampones, veamos primero cómo se ve afectado el equilibrio de ionización de un ácido débil al agregar la base conjugada del ácido o un ácido fuerte (una fuente de ( ce {H ^ {+} } )). El principio de Le Chatelier puede usarse para predecir el efecto sobre la posición de equilibrio de la solución. Un tampón típico utilizado en los laboratorios de bioquímica contiene ácido acético y una sal como el acetato de sodio. La reacción de disociación del ácido acético es la siguiente:
[ ce {CH3COOH (aq) <=> CH3COO ^ {-} (aq) + H ^ {+} (aq)} label {Eq1} ]
y la expresión de equilibrio constante es la siguiente:
[K_a = dfrac {[ ce {H ^ {+}}] [ ce {CH3COO ^ {-}}]} {[ ce {CH3CO2H}]} label {Eq2} ] [ 19459010]
El acetato de sodio ( (CH_3CO_2Na )) es un electrolito fuerte que se ioniza completamente en solución acuosa para producir ( ce {Na ^ {+}} ) y ( ce {CH3CO2 ^ {-}} ) iones. Si se agrega acetato de sodio a una solución de ácido acético, el principio de Le Chatelier predice que el equilibrio en la ecuación ref {Eq1} se desplazará hacia la izquierda, consumiendo parte del ( ce {CH_3COO ^ ^ -}} ) y algunos de los iones ( ce {H ^ {+}} ) originalmente presentes en la solución.
Debido a que ( ce {Na ^ {+}} ) es un ión espectador , no tiene ningún efecto sobre la posición del equilibrio y puede ignorarse. La adición de acetato de sodio produce una nueva composición de equilibrio, en la que ([ ce {H ^ {+}}] ) es menor que el valor inicial. Debido a que ([ ce {H ^ {+}}] ) ha disminuido, el pH será más alto. Por lo tanto, agregar una sal de la base conjugada a una solución de un ácido débil aumenta el pH. Esto tiene sentido porque el acetato de sodio es una base, y agregar cualquier base a una solución de un ácido débil debería aumentar el pH.
Si en cambio agregamos un ácido fuerte como (HCl ) al sistema, ([ ce {H ^ {+}}] ) aumenta. Una vez más, el equilibrio se altera temporalmente, pero el exceso de ( ce {H ^ {+}} ) iones reacciona con la base conjugada ( (CH_3CO_2 ^ – )), ya sea del ácido original o acetato de sodio, a conducir el equilibrio hacia la izquierda. El resultado neto es una nueva composición de equilibrio que tiene un [ (CH_3CO_2 ^ – )] más bajo que antes. En ambos casos, solo la composición de equilibrio ha cambiado; La constante de ionización (K_a ) para el ácido acético sigue siendo la misma. Agregar un electrolito fuerte que contiene un ion en común con un sistema de reacción que está en equilibrio, en este caso (CH_3CO_2 ^ – ), por lo tanto, cambiará el equilibrio en la dirección que reduce la concentración del ion común. El cambio en el equilibrio es a través del efecto de iones comunes.
Agregar un ion común a un sistema en equilibrio afecta la composición de equilibrio, pero no la constante de ionización.
Ahora supongamos que tenemos una solución tampón que contiene concentraciones equimolares de una base débil ( (B )) y su ácido conjugado ( (BH ^ + )). La ecuación general para la ionización de una base débil es la siguiente:
[B (aq) + H_2O (l) leftrightharpoons BH ^ + (aq) + OH ^ – (aq) label {Eq3} ]
Si la constante de equilibrio para la reacción como está escrita en la Ecuación ( ref {Eq3} ) es pequeña, por ejemplo (K_b = 10 ^ {- 5} ), entonces la constante de equilibrio para la reacción inversa es muy grande: (K = dfrac {1} {K_b} = 10 ^ 5 ). Por lo tanto, agregar una base fuerte como (OH ^ – ) a la solución hace que el equilibrio en la ecuación ( ref {Eq3} ) se desplace hacia la izquierda, consumiendo el (OH ^ – ) agregado. Como resultado, la concentración de iones (OH ^ – ) en la solución permanece relativamente constante y el pH de la solución cambia muy poco. El principio de Le Chatelier predice el mismo resultado: cuando el sistema está estresado por un aumento en la concentración de iones (OH ^ – ), la reacción procederá a la izquierda para contrarrestar el estrés.
Si el (pK_b ) de la base es 5.0, el (pK_a ) de su ácido conjugado es
[pK_a = pK_w – pK_b = 14.0 – 5.0 = 9.0. ]
Por lo tanto, la constante de equilibrio para la ionización del ácido conjugado es incluso menor que la de la ionización de la base. La reacción de ionización para el ácido conjugado de una base débil se escribe como sigue:
[BH ^ + (aq) + H_2O (l) leftrightharpoons B (aq) + H_3O ^ + (aq) label {Eq4} ]
Nuevamente, la constante de equilibrio para el reverso de esta reacción es muy grande: K = 1 / K a = 10 9 . Si se agrega un ácido fuerte, se neutraliza por reacción con la base a medida que la reacción en la Ecuación ( ref {Eq4} ) se desplaza hacia la izquierda. Como resultado, la concentración de iones (H ^ + ) no aumenta mucho, y el pH cambia solo ligeramente. En efecto, una solución tampón se comporta como una esponja que puede absorber los iones (H ^ + ) y (OH ^ – ), evitando así grandes cambios en el pH cuando se agregan cantidades apreciables de ácido o base fuerte a una solución .
Los tampones se caracterizan por el rango de pH en el que pueden mantener un pH más o menos constante y por su capacidad de tampón, la cantidad de ácido o base fuerte que puede absorberse antes de que el pH cambie significativamente. Aunque el rango de pH útil de un tampón depende en gran medida de las propiedades químicas del ácido débil y la base débil utilizada para preparar el tampón (es decir, en (K )), su capacidad de tampón depende únicamente de las concentraciones de las especies en el solución tamponada Cuanto más concentrada es la solución tampón, mayor es su capacidad tampón. Como se ilustra en la Figura ( PageIndex {1} ), cuando (NaOH ) se agrega a soluciones que contienen diferentes concentraciones de un tampón de ácido acético / acetato de sodio, el cambio observado en el pH del tampón es inversamente proporcional a La concentración del tampón. Si la capacidad del tampón es 10 veces mayor, entonces la solución del tampón puede absorber 10 veces más ácido o base fuerte antes de experimentar un cambio significativo en el pH.
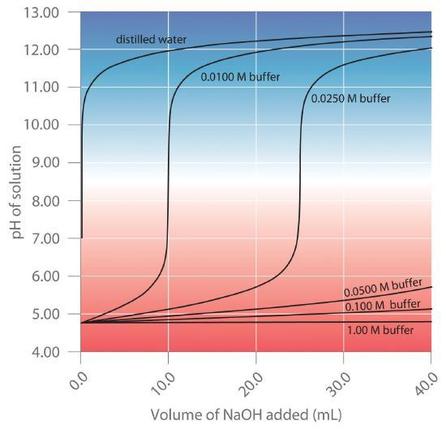
Un tampón mantiene un pH relativamente constante cuando se agrega ácido o base a una solución. La adición de incluso pequeños volúmenes de 0,10 M (NaOH ) a 100,0 ml de agua destilada da como resultado un cambio muy grande en el pH. A medida que la concentración de una mezcla 50:50 de tampón de acetato de sodio / ácido acético en la solución aumenta de 0.010 M a 1.00 M, el cambio en el pH producido por la adición del mismo volumen de solución (NaOH ) disminuye constantemente . Para concentraciones de tampón de al menos 0.500 M, la adición de incluso 25 ml de la solución (NaOH ) da como resultado solo un cambio relativamente pequeño en el pH.
Cálculo del pH de un tampón
El pH de un tampón se puede calcular a partir de las concentraciones del ácido débil y la base débil utilizada para prepararlo, la concentración de la base conjugada y el ácido conjugado, y el (pK_a ) o (pK_b ) del ácido débil o base débil. El procedimiento es análogo al utilizado en el Ejemplo ( PageIndex {1} ) para calcular el pH de una solución que contiene concentraciones conocidas de ácido fórmico y formiato.
Un método alternativo utilizado frecuentemente para calcular el pH de una solución tampón se basa en una reordenación de la ecuación de equilibrio para la disociación de un ácido débil. La reacción de ionización simplificada es (HA leftrightharpoons H ^ + + A ^ – ), para lo cual la expresión constante de equilibrio es la siguiente:
[K_a = dfrac {[H ^ +] [A ^ -]} {[HA]} label {Eq5} ]
Esta ecuación se puede reorganizar de la siguiente manera:
[[H ^ +] = K_a dfrac {[HA]} {[A ^ -]} label {Eq6} ]
Tomando el logaritmo de ambos lados y multiplicando ambos lados por −1,
[ begin {align} – log [H ^ +] & = – log K_a− log left ( dfrac {[HA]} {[A ^ -]} right) \ [ 4pt] & = – log {K_a} + log left ( dfrac {[A ^ -]} {[HA]} right) label {Eq7} end {align} ]
Reemplazando los logaritmos negativos en la ecuación ( ref {Eq7} ),
[pH = pK_a + log left ( dfrac {[A ^ -]} {[HA]} right) label {Eq8} ]
o, más generalmente,
[pH = pK_a + log left ( dfrac {[base]} {[ácido]} right) label {Eq9} ]
La ecuación ( ref {Eq8} ) y la ecuación ( ref {Eq9} ) son ambas formas de la aproximación Henderson-Hasselbalch , nombrada en honor a los dos químicos de principios del siglo XX que Primero noté que esta versión reorganizada de la expresión constante de equilibrio proporciona una manera fácil de calcular el pH de una solución tampón. En general, la validez de la aproximación de Henderson-Hasselbalch puede limitarse a soluciones cuyas concentraciones son al menos 100 veces mayores que sus valores (K_a ).
Hay tres casos especiales en los que la aproximación de Henderson-Hasselbalch se interpreta fácilmente sin necesidad de cálculos:
- ([base] = [ácido] ): en estas condiciones, [ dfrac {[base]} {[ácido]} = 1 ] en la ecuación ( ref {Eq9} ). Porque ( log 1 = 0 ), [pH = pK_a ] independientemente de las concentraciones reales de ácido y base. Recuerde que esto corresponde al punto medio en la titulación de un ácido débil o una base débil.
- ([base] / [ácido] = 10 ): en la ecuación ( ref {Eq9} ), porque ( log 10 = 1 ), [pH = pK_a + 1. ]
- ([base] / [ácido] = 100 ): en la ecuación ( ref {Eq9} ), porque ( log 100 = 2 ), [pH = pK_a + 2. ]
Cada vez que aumentamos la relación [base] / [ácido] en 10, el pH de la solución aumenta en 1 unidad de pH. Por el contrario, si la relación [base] / [ácido] es 0.1, entonces pH = (pK_a ) – 1. Cada disminución adicional del factor de 10 en la relación [base] / [ácido] hace que el pH disminuya en 1 unidad de pH.
La aproximación de Henderson-Hasselbalch ((Ecuación ( ref {Eq8} )) también se puede usar para calcular el pH de una solución tampón después de agregar una cantidad dada de ácido fuerte o base fuerte, como se demuestra en el Ejemplo ( PageIndex {3} ).
Los resultados obtenidos en el Ejemplo ( PageIndex {3} ) y su ejercicio correspondiente demuestran cuán poco cambia el pH de una solución tampón bien elegida a pesar de la adición de una cantidad significativa de ácido fuerte o base fuerte. Supongamos que hemos agregado la misma cantidad de solución (HCl ) o (NaOH ) a 100 ml de una solución no tamponada a pH 3,95 (correspondiente a (1,1 veces 10 ^ {- 4} ) M HCl). En este caso, agregar 5.00 mL de 1.00 M (HCl ) reduciría el pH final a 1.32 en lugar de 3.70, mientras que agregar 5.00 mL de 1.00 M (NaOH ) elevaría el pH final a 12.68 en lugar de 4.24. (Intente verificar estos valores haciendo los cálculos usted mismo). Por lo tanto, la presencia de un tampón aumenta significativamente la capacidad de una solución para mantener un pH casi constante.
Los tampones más efectivos contienen concentraciones iguales de un ácido y su base conjugada.
Un tampón que contiene cantidades aproximadamente iguales de un ácido débil y su base conjugada en solución es igualmente eficaz para neutralizar la base agregada o el ácido agregado. Esto se muestra en la Figura ( PageIndex {2} ) para un tampón de ácido acético / acetato de sodio. Agregar una cantidad dada de ácido fuerte desplaza el sistema a lo largo del eje horizontal hacia la izquierda, mientras que agregar la misma cantidad de base fuerte desplaza el sistema la misma distancia hacia la derecha. En cualquier caso, el cambio en la relación de (CH_3CO_2 ^ – ) a (CH_3CO_2H ) de 1: 1 reduce la capacidad de la solución tampón.
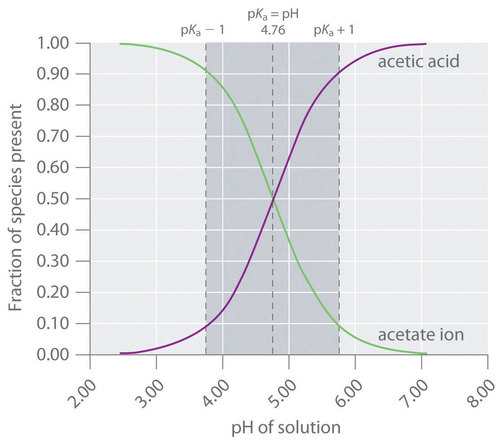
The Relationship between Titrations and Buffers
There is a strong correlation between the effectiveness of a buffer solution and the titration curves discussed in Section 16.5. Consider the schematic titration curve of a weak acid with a strong base shown in Figure (PageIndex{3}). As indicated by the labels, the region around (pK_a) corresponds to the midpoint of the titration, when approximately half the weak acid has been neutralized. This portion of the titration curve corresponds to a buffer: it exhibits the smallest change in pH per increment of added strong base, as shown by the nearly horizontal nature of the curve in this region. The nearly flat portion of the curve extends only from approximately a pH value of 1 unit less than the (pK_a) to approximately a pH value of 1 unit greater than the (pK_a), which is why buffer solutions usually have a pH that is within ±1 pH units of the (pK_a) of the acid component of the buffer.

This schematic plot of pH for the titration of a weak acid with a strong base shows the nearly flat region of the titration curve around the midpoint, which corresponds to the formation of a buffer. At the lower left, the pH of the solution is determined by the equilibrium for dissociation of the weak acid; at the upper right, the pH is determined by the equilibrium for reaction of the conjugate base with water.
In the region of the titration curve at the lower left, before the midpoint, the acid–base properties of the solution are dominated by the equilibrium for dissociation of the weak acid, corresponding to (K_a). In the region of the titration curve at the upper right, after the midpoint, the acid–base properties of the solution are dominated by the equilibrium for reaction of the conjugate base of the weak acid with water, corresponding to (K_b). However, we can calculate either (K_a) or (K_b) from the other because they are related by (K_w).
Blood: A Most Important Buffer
Metabolic processes produce large amounts of acids and bases, yet organisms are able to maintain an almost constant internal pH because their fluids contain buffers. This is not to say that the pH is uniform throughout all cells and tissues of a mammal. The internal pH of a red blood cell is about 7.2, but the pH of most other kinds of cells is lower, around 7.0. Even within a single cell, different compartments can have very different pH values. For example, one intracellular compartment in white blood cells has a pH of around 5.0.
Because no single buffer system can effectively maintain a constant pH value over the entire physiological range of approximately pH 5.0 to 7.4, biochemical systems use a set of buffers with overlapping ranges. The most important of these is the (CO_2/HCO_3^−) system, which dominates the buffering action of blood plasma.
The acid–base equilibrium in the (CO_2/HCO_3^−) buffer system is usually written as follows:
[H_2CO_3 (aq) leftrightharpoons H^+ (aq) +HCO^−_3 (aq) label{Eq10}]
with (K_a = 4.5 times 10^{−7}) and (pK_a = 6.35) at 25°C. In fact, Equation (ref{Eq10}) is a grossly oversimplified version of the (CO_2/HCO_3^−) system because a solution of (CO_2) in water contains only rather small amounts of (H_2CO_3). Thus Equation (ref{Eq10}) does not allow us to understand how blood is actually buffered, particularly at a physiological temperature of 37°C. As shown in Equation (ref{Eq11}), (CO_2) is in equilibrium with (H_2CO_3), but the equilibrium lies far to the left, with an (H_2CO_3/CO_2) ratio less than 0.01 under most conditions:
[CO_2 (aq) +H_2O (l) leftrightharpoons H_2CO_3 (aq) label{Eq11}]
with (K′ = 4.0 times 10^{−3}) at 37°C. The true (pK_a) of carbonic acid at 37°C is therefore 3.70, not 6.35, corresponding to a (K_a) of (2.0 times 10^{−4}), which makes it a much stronger acid than Equation (ref{Eq10}) suggests. Adding Equation (ref{Eq10}) and Equation (ref{Eq11}) and canceling (H_2CO_3) from both sides give the following overall equation for the reaction of (CO_2) with water to give a proton and the bicarbonate ion:
[CO_2 (aq) +H_2O (l) leftrightharpoons H_2CO_3 (aq) label{16.65a}]
with (K’=4.0 times 10^{−3} (37°C))
[ H_2CO_3 (aq) leftrightharpoons H^+ (aq) + HCO^−_3 (aq) label{16.65b}]
with (K_a=2.0 times 10^{−4} (37°C) )
[CO_2 (aq) +H_2O (l) leftrightharpoons H^+ (aq) +HCO^−_3 (aq) label{16.65c}]
with (K=8.0 times 10^{−7} (37°C))
The (K) value for the reaction in Equation (ref{Eq1})2 is the product of the true ionization constant for carbonic acid ((K_a)) and the equilibrium constant (K) for the reaction of (CO_2 (aq) ) with water to give carbonic acid. The equilibrium equation for the reaction of (CO_2) with water to give bicarbonate and a proton is therefore
[K=dfrac{[H^+][HCO_3^−]}{[CO_2]}=8.0 times 10^{−7} label{Eq12}]
The presence of a gas in the equilibrium constant expression for a buffer is unusual. According to Henry’s law ,
[[CO_2]=k P_{CO_2}]
where (k) is the Henry’s law constant for (CO_2), which is (3.0 times 10^{−5} ;M/mmHg) at 37°C. Substituting this expression for ([CO_2]) in Equation (ref{Eq13}),
[K=dfrac{[H^+][HCO_3^−]}{(3.0 times 10^{−5}; M/mmHg)(P_{CO_2})} label{Eq14}]
where (P_{CO_2}) is in mmHg. Taking the negative logarithm of both sides and rearranging,
[pH=6.10+log left( dfrac{ [HCO_3^−]}{(3.0 times 10^{−5} M/mm ;Hg); (P_{CO_2}) } right) label{Eq15}]
Thus the pH of the solution depends on both the (CO_2) pressure over the solution and ([HCO_3^−]). Figure (PageIndex{4}) plots the relationship between pH and ([HCO_3^−]) under physiological conditions for several different values of (P_{CO_2}), with normal pH and ([HCO_3^−]) values indicated by the dashed lines.
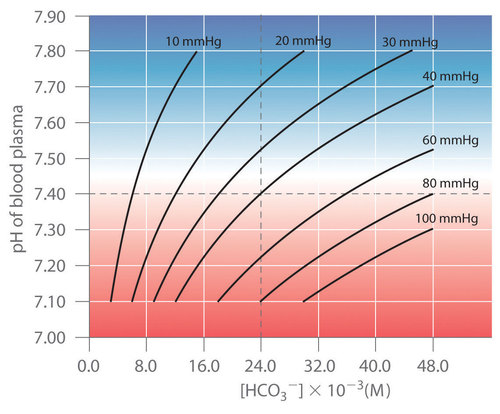
According to Equation (ref{Eq15}), adding a strong acid to the (CO_2/HCO_3^−) system causes ([HCO_3^−]) to decrease as (HCO_3^−) is converted to (CO_2). Excess (CO_2) is released in the lungs and exhaled into the atmosphere, however, so there is essentially no change in (P_{CO_2}). Because the change in ([HCO_3^−]/P_{CO_2}) is small, Equation (ref{Eq15}) predicts that the change in pH will also be rather small. Conversely, if a strong base is added, the (OH^-) reacts with CO2 to form ([HCO_3^−]), but (CO_2) is replenished by the body, again limiting the change in both ([HCO_3^−]/P_{CO_2}) and pH. The (CO_2/HCO_3^−) buffer system is an example of an open system, in which the total concentration of the components of the buffer change to keep the pH at a nearly constant value.
If a passenger steps out of an airplane in Denver, Colorado, for example, the lower (P_{CO_2}) at higher elevations (typically 31 mmHg at an elevation of 2000 m versus 40 mmHg at sea level) causes a shift to a new pH and ([HCO_3^−]). The increase in pH and decrease in ([HCO_3^−]) in response to the decrease in (P_{CO_2}) are responsible for the general malaise that many people experience at high altitudes. If their blood pH does not adjust rapidly, the condition can develop into the life-threatening phenomenon known as altitude sickness.
Summary
Buffers are solutions that resist a change in pH after adding an acid or a base. Buffers contain a weak acid ((HA)) and its conjugate weak base ((A^−)). Adding a strong electrolyte that contains one ion in common with a reaction system that is at equilibrium shifts the equilibrium in such a way as to reduce the concentration of the common ion. The shift in equilibrium is called the common ion effect. Buffers are characterized by their pH range and buffer capacity. The useful pH range of a buffer depends strongly on the chemical properties of the conjugate weak acid–base pair used to prepare the buffer (the (K_a) or (K_b)), whereas its buffer capacity depends solely on the concentrations of the species in the solution. The pH of a buffer can be calculated using the Henderson-Hasselbalch approximation, which is valid for solutions whose concentrations are at least 100 times greater than their (K_a) values. Because no single buffer system can effectively maintain a constant pH value over the physiological range of approximately 5 to 7.4, biochemical systems use a set of buffers with overlapping ranges. The most important of these is the (CO_2/HCO_3^−) system, which dominates the buffering action of blood plasma.