Cuando un soluto se disuelve, sus átomos, moléculas o iones individuales interactúan con el solvente, se solvatan y pueden difundirse independientemente a través de la solución (Figura ( PageIndex {1a} )). Sin embargo, este no es un proceso unidireccional. Si la molécula o el ion chocan con la superficie de una partícula del soluto no disuelto, puede adherirse a la partícula en un proceso llamado cristalización. La disolución y la cristalización continúan mientras exista un exceso de sólido, lo que da como resultado un equilibrio dinámico análogo al equilibrio que mantiene la presión de vapor de un líquido. Podemos representar estos procesos opuestos de la siguiente manera:
[ text {solute} + text {solvente} ce {<=> [ ce {cristalización}] [ ce {disolución}]} text {solución} label {13.2.1} ]
Aunque los términos precipitación y cristalización se usan para describir la separación del soluto sólido de una solución, la cristalización se refiere a la formación de un sólido con una estructura cristalina bien definida, mientras que la precipitación se refiere a la formación de cualquier fase sólida, a menudo uno con partículas muy pequeñas.

Factores que afectan la solubilidad
La cantidad máxima de un soluto que puede disolverse en un solvente a una temperatura y presión especificadas es su solubilidad. La solubilidad a menudo se expresa como la masa de soluto por volumen (g / L) o la masa de soluto por masa de solvente (g / g), o como los moles de soluto por volumen (mol / L). Sin embargo, incluso para sustancias muy solubles, generalmente hay un límite para la cantidad de soluto que puede disolverse en una cantidad dada de solvente. En general, la solubilidad de una sustancia depende no solo de los factores energéticos que hemos discutido sino también de la temperatura y, para los gases, la presión. A 20 ° C, por ejemplo, 177 g de NaI, 91.2 g de NaBr, 35.9 g de NaCl y solo 4.1 g de NaF se disuelven en 100 g de agua. Sin embargo, a 70 ° C, las solubilidades aumentan a 295 g de NaI, 119 g de NaBr, 37.5 g de NaCl y 4.8 g de NaF. Como aprendió en el Capítulo 12, las energías reticulares de los haluros de sodio aumentan de NaI a NaF. El hecho de que las solubilidades disminuyan a medida que aumenta la energía de la red sugiere que el término (ΔH_2 ) en la Figura 13.1 domina para esta serie de compuestos.
Una solución con la máxima cantidad posible de soluto está saturada. Si una solución contiene menos de la cantidad máxima de soluto, es insaturada. Cuando una solución está saturada y hay un exceso de soluto, la velocidad de disolución es exactamente igual a la velocidad de cristalización (Figura ( PageIndex {1b} )). Usando el valor que se acaba de indicar, una solución acuosa saturada de NaCl, por ejemplo, contiene 35,9 g de NaCl por 100 ml de agua a 20 ° C. Podemos preparar una solución saturada homogénea agregando un exceso de soluto (en este caso, más de 35.9 g de NaCl) al solvente (agua), agitando hasta que se disuelva la cantidad máxima posible de soluto, y luego eliminando el soluto no disuelto por filtración.
La solubilidad de la mayoría de los sólidos aumenta con el aumento de la temperatura.
Debido a que la solubilidad de la mayoría de los sólidos aumenta con el aumento de la temperatura, una solución saturada que se preparó a una temperatura más alta generalmente contiene más soluto disuelto del que contendría a una temperatura menor. Cuando la solución se enfría, puede quedar sobresaturada (Figura ( PageIndex {1c} )). Al igual que un líquido sobreenfriado o sobrecalentado, una solución sobresaturada es inestable. En consecuencia, la adición de una pequeña partícula del soluto, un cristal semilla, generalmente hará que el soluto en exceso precipite o cristalice rápidamente, a veces con resultados espectaculares. La velocidad de cristalización en la ecuación ( ref {13.2.1} ) es mayor que la velocidad de disolución, por lo que los cristales o una forma de precipitado (Figura ( PageIndex {1d} )). Por el contrario, agregar un cristal semilla a una solución saturada restablece el equilibrio dinámico, y la cantidad neta de soluto disuelto ya no cambia.
Video ( PageIndex {1} ): hermoso experimento científico de hielo caliente (acetato de sodio). trihidrato de acetato de sodio diluido. El cristal de agujas es estructuras realmente maravillosas
Debido a que la cristalización es el reverso de la disolución, una sustancia que requiere una entrada de calor para formar una solución ( (ΔH_ {soln}> 0 )) libera ese calor cuando se cristaliza en la solución ( (ΔH_ {crys} <0 )). La cantidad de calor liberado es proporcional a la cantidad de soluto que excede su solubilidad. Dos sustancias que tienen una entalpía positiva de solución son el tiosulfato de sodio ( (Na_2S_2O_3 )) y el acetato de sodio ( (CH_3CO_2Na )), que se usan en paquetes calientes comerciales, pequeñas bolsas de soluciones sobresaturadas que se usan para calentar las manos ( ver Figura 13.1.3).
Interacciones en soluciones líquidas
Las interacciones que determinan la solubilidad de una sustancia en un líquido dependen en gran medida de la naturaleza química del soluto (como si es iónico o molecular) en lugar de su estado físico (sólido, líquido o gaseoso). Primero describiremos el caso general de formar una solución de una especie molecular en un solvente líquido y luego describiremos la formación de una solución de un compuesto iónico.
Soluciones de sustancias moleculares en líquidos
Las fuerzas de dispersión de Londres, las interacciones dipolo-dipolo y los enlaces de hidrógeno que mantienen moléculas a otras moléculas son generalmente débiles. Aun así, se requiere energía para interrumpir estas interacciones. Como se describe en la Sección 13.1, a menos que parte de esa energía se recupere en la formación de nuevas interacciones favorables de soluto-disolvente, el aumento de la entropía en la formación de la solución no es suficiente para que se forme una solución.
Para soluciones de gases en líquidos, podemos ignorar con seguridad la energía requerida para separar las moléculas de soluto ( (ΔH_2 = 0 )) porque las moléculas ya están separadas. Por lo tanto, debemos considerar solo la energía requerida para separar las moléculas de solvente ( (ΔH_1 )) y la energía liberada por las nuevas interacciones soluto-solvente ( (ΔH_3 )). Los gases no polares como (N_2 ), (O_2 ) y (Ar ) no tienen momento dipolar y no pueden participar en interacciones dipolo-dipolo o enlaces de hidrógeno. En consecuencia, la única forma en que pueden interactuar con un solvente es mediante las fuerzas de dispersión de Londres, que pueden ser más débiles que las interacciones solvente-solvente en un solvente polar. No es sorprendente, entonces, que los gases no polares sean más solubles en solventes no polares. En este caso, (ΔH_1 ) y (ΔH_3 ) son pequeños y de magnitud similar. En contraste, para una solución de un gas no polar en un solvente polar, (ΔH_1 ) es mucho mayor que (ΔH_3 ). Como resultado, los gases no polares son menos solubles en solventes polares que en solventes no polares. Por ejemplo, la concentración de (N_2 ) en una solución saturada de (N_2 ) en agua, un solvente polar, es solo (7.07 times 10 ^ {- 4} ; M ) en comparación con ( 4.5 times 10 ^ {- 3} ; M ) para una solución saturada de (N_2 ) en benceno, un solvente no polar.
Las solubilidades de los gases no polares en el agua generalmente aumentan a medida que aumenta la masa molecular del gas, como se muestra en la Tabla ( PageIndex {1} ). Esta es precisamente la tendencia esperada: a medida que las moléculas de gas se hacen más grandes, la fuerza de las interacciones solvente-soluto debido a las fuerzas de dispersión de Londres aumenta, acercándose a la fuerza de las interacciones solvente-solvente.
| Gas | Solubilidad (M) × 10 −4 |
|---|---|
| Él | 3,90 |
| Ne | 4,65 |
| Ar | 15,2 |
| Kr | 27,9 |
| Xe | 50,2 |
| H 2 | 8,06 |
| N 2 | 7,07 |
| CO | 10,6 |
| O2 | 13,9 |
| N 2 O | 281 |
| CH 4 | 15,5 |
Prácticamente todos los líquidos orgánicos comunes, polares o no, son miscibles. Los puntos fuertes de las atracciones intermoleculares son comparables; por lo tanto, se espera que la entalpía de la solución sea pequeña ( (ΔH_ {soln} aprox 0 )), y el aumento de la entropía impulsa la formación de una solución. Sin embargo, si las interacciones intermoleculares predominantes en dos líquidos son muy diferentes entre sí, pueden ser inmiscibles. Por ejemplo, los líquidos orgánicos como el benceno, el hexano, (CCl_4 ) y (CS_2 ) (S = C = S) son no polares y no tienen la capacidad de actuar como donantes o aceptores de enlaces de hidrógeno con solventes de enlace de hidrógeno como como (H_2O ), (HF ) y (NH_3 ); por lo tanto, son inmiscibles en estos solventes. Cuando se agitan con agua, forman fases o capas separadas separadas por una interfaz (Figura ( PageIndex {2} )), la región entre las dos capas.

El hecho de que dos líquidos sean inmiscibles, sin embargo, no significa que sean completamente insolubles entre sí. Por ejemplo, 188 mg de benceno se disuelven en 100 ml de agua a 23.5 ° C. Agregar más benceno da como resultado la separación de una capa superior que consiste en benceno con una pequeña cantidad de agua disuelta (la solubilidad del agua en benceno es de solo 178 mg / 100 ml de benceno). Las solubilidades de los alcoholes simples en agua se dan en la Tabla ( PageIndex {2} ).
| Alcohol | Solubilidad (mol / 100 g de (H_2O )) |
|---|---|
| metanol | completamente miscible |
| etanol | completamente miscible |
| n-propanol | completamente miscible |
| n-butanol | 0,11 |
| n-pentanol | 0,030 |
| n-hexanol | 0,0058 |
| n-heptanol | 0,0008 |
Solo los tres alcoholes más ligeros (metanol, etanol y n-propanol) son completamente miscibles con agua. A medida que aumenta la masa molecular del alcohol, también lo hace la proporción de hidrocarburos en la molécula. En consecuencia, la importancia del enlace de hidrógeno y las interacciones dipolo-dipolo en el alcohol puro disminuye, mientras que la importancia de las fuerzas de dispersión de Londres aumenta, lo que conduce a progresivamente menos interacciones electrostáticas favorables con el agua. Los líquidos orgánicos como la acetona, el etanol y el tetrahidrofurano son suficientemente polares para ser completamente miscibles con agua, pero lo suficientemente no polares como para ser completamente miscibles con todos los solventes orgánicos.
Los mismos principios rigen las solubilidades de los sólidos moleculares en líquidos. Por ejemplo, el azufre elemental es un sólido que consiste en moléculas cíclicas (S_8 ) que no tienen momento dipolar. Debido a que los anillos (S_8 ) en azufre sólido están sujetos a otros anillos por las fuerzas de dispersión de Londres, el azufre elemental es insoluble en agua. Sin embargo, es soluble en solventes no polares que tienen fuerzas de dispersión de Londres comparables, como (CS_2 ) (23 g / 100 mL). En contraste, la glucosa contiene cinco grupos –OH que pueden formar enlaces de hidrógeno. En consecuencia, la glucosa es muy soluble en agua (91 g / 120 ml de agua) pero esencialmente insoluble en solventes no polares como el benceno. La estructura de un isómero de glucosa se muestra aquí.

Los hidrocarburos de baja masa molecular con átomos de halógeno altamente electronegativos y polarizables, como el cloroformo ( (CHCl_3 )) y el cloruro de metileno ( (CH_2Cl_2 )), tienen momentos dipolares significativos y fuerzas de dispersión relativamente fuertes en Londres. Por lo tanto, estos hidrocarburos son solventes poderosos para una amplia gama de compuestos polares y no polares. La naftaleno, que es no polar, y el fenol ( (C_6H_5OH )), que es polar, son muy solubles en cloroformo. Por el contrario, la solubilidad de los compuestos iónicos está determinada en gran medida no por la polaridad del disolvente, sino por su constante dieléctrica, una medida de su capacidad para separar iones en solución, como pronto verá.
Solutos hidrófilos e hidrófobos
Un soluto se puede clasificar como hidrofílico (literalmente, “amante del agua”), lo que significa que tiene una atracción electrostática al agua, o hidrofóbico (“miedo al agua”), lo que significa que repele el agua. Una sustancia hidrofílica es polar y a menudo contiene grupos O – H o N – H que pueden formar enlaces de hidrógeno al agua. Por ejemplo, la glucosa con sus cinco grupos O-H es hidrofílica. En contraste, una sustancia hidrofóbica puede ser polar pero generalmente contiene enlaces C-H que no interactúan favorablemente con el agua, como es el caso con el naftaleno y el n-octano. Las sustancias hidrófilas tienden a ser muy solubles en agua y otros solventes fuertemente polares, mientras que las sustancias hidrófobas son esencialmente insolubles en agua y solubles en solventes no polares como el benceno y el ciclohexano.
La diferencia entre las sustancias hidrofílicas e hidrofóbicas tiene consecuencias sustanciales en los sistemas biológicos. Por ejemplo, las vitaminas se pueden clasificar como solubles en grasa o solubles en agua. Las vitaminas liposolubles, como la vitamina A, son principalmente moléculas hidrofóbicas no polares. Como resultado, tienden a ser absorbidos por los tejidos grasos y almacenados allí. Por el contrario, las vitaminas solubles en agua, como la vitamina C, son moléculas polares hidrofílicas que circulan en la sangre y en los fluidos intracelulares, que son principalmente acuosos. Por lo tanto, las vitaminas solubles en agua se excretan mucho más rápidamente del cuerpo y deben reponerse en nuestra dieta diaria. Una comparación de las estructuras químicas de la vitamina A y la vitamina C revela rápidamente por qué una es hidrófoba y la otra hidrófila.
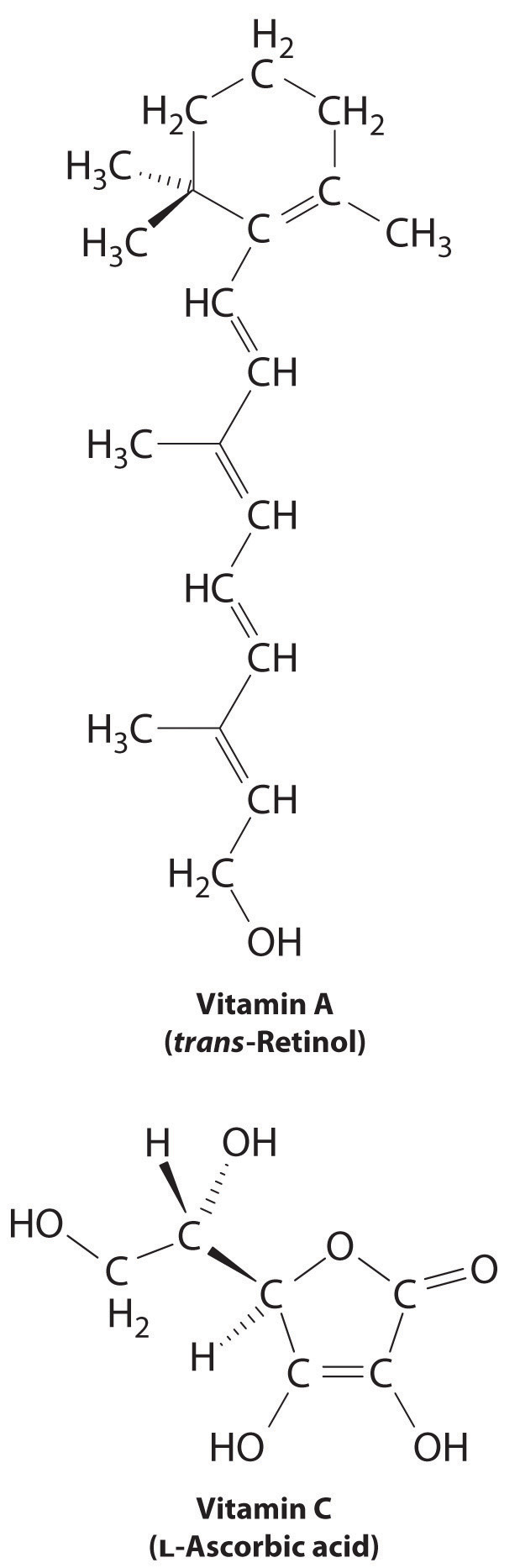
Debido a que las vitaminas solubles en agua se excretan rápidamente, el riesgo de consumirlas en exceso es relativamente pequeño. Es probable que comer una docena de naranjas al día te canse de las naranjas mucho antes de que sufras efectos nocivos debido a su alto contenido de vitamina C. En contraste, las vitaminas liposolubles constituyen un peligro significativo para la salud cuando se consumen en grandes cantidades. Por ejemplo, los hígados de los osos polares y otros animales grandes que viven en climas fríos contienen grandes cantidades de vitamina A, que ocasionalmente han resultado fatales para los humanos que los han comido.
Soluciones sólidas
Las soluciones no se limitan a gases y líquidos; También existen soluciones sólidas. Por ejemplo, las amalgamas, que generalmente son sólidas, son soluciones de metales en mercurio líquido. Debido a que la mayoría de los metales son solubles en mercurio, las amalgamas se usan en la minería de oro, la odontología y muchas otras aplicaciones. Una gran dificultad cuando se extrae oro es separar partículas muy pequeñas de oro puro de toneladas de roca triturada. Una forma de lograr esto es agitar una suspensión de la roca triturada con mercurio líquido, que disuelve el oro (así como cualquier plata metálica que pueda estar presente). La muy densa amalgama de oro y mercurio líquido se aísla y el mercurio se destila.
Una aleación es una solución sólida o líquida que consta de uno o más elementos en una matriz metálica. Una aleación sólida tiene una única fase homogénea en la que la estructura cristalina del disolvente permanece inalterada por la presencia del soluto. Así, la microestructura de la aleación es uniforme en toda la muestra. Los ejemplos son aleaciones sustitucionales e intersticiales como el latón o la soldadura. Las aleaciones líquidas incluyen sodio / potasio y oro / mercurio. En contraste, una solución de aleación parcial tiene dos o más fases que pueden ser homogéneas en la distribución de los componentes, pero las microestructuras de las dos fases no son las mismas. A medida que se enfría una solución líquida de plomo y estaño, por ejemplo, se forman diferentes fases cristalinas a diferentes temperaturas de enfriamiento. Las aleaciones generalmente tienen propiedades que difieren de las de los elementos componentes.
Los sólidos de red como el diamante, el grafito y ( ce {SiO_2} ) son insolubles en todos los solventes con los que no reaccionan químicamente. Los enlaces covalentes que mantienen unida la red o la red son simplemente demasiado fuertes para romperse en condiciones normales. Ciertamente, son mucho más fuertes que cualquier combinación concebible de interacciones intermoleculares que puedan ocurrir en la solución. La mayoría de los metales son insolubles en prácticamente todos los solventes por la misma razón: el enlace metálico deslocalizado es mucho más fuerte que cualquier interacción favorable entre el átomo de metal y el solvente. Muchos metales reaccionan con soluciones como ácidos o bases acuosas para producir una solución. Sin embargo, como vimos en la Sección 13.1, en estos casos el metal sufre una transformación química que no se puede revertir simplemente eliminando el solvente.
Los sólidos con enlaces intermoleculares muy fuertes tienden a ser insolubles.
Solubilidades de sustancias iónicas en líquidos
Anteriormente , se le presentaron pautas para predecir la solubilidad de los compuestos iónicos en el agua. Las sustancias iónicas son generalmente más solubles en solventes polares; cuanto mayor es la energía de la red, más polar debe ser el solvente para superar la energía de la red y disolver la sustancia. Debido a su alta polaridad, el agua es el solvente más común para los compuestos iónicos. Sin embargo, muchos compuestos iónicos son solubles en otros disolventes polares, como el amoníaco líquido, el fluoruro de hidrógeno líquido y el metanol. Debido a que todos estos solventes consisten en moléculas que tienen momentos dipolares relativamente grandes, pueden interactuar favorablemente con los iones disueltos.
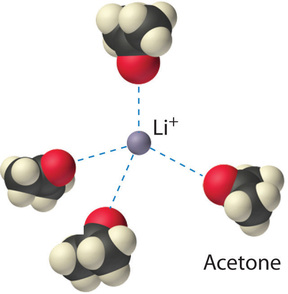
Las interacciones ion-dipolo entre ( ce {Li ^ {+}} ) iones y moléculas de acetona en una solución de LiCl en acetona se muestran en la Figura ( PageIndex {3} ). Las interacciones energéticamente favorables ( ce {Li ^ {+}} ) – acetona hacen que (ΔH_3 ) sea suficientemente negativo para superar los positivos (ΔH_1 ) y (ΔH_2 ). Debido a que el momento dipolar de la acetona (2.88 D), y por lo tanto su polaridad, es en realidad mayor que el del agua (1.85 D), incluso se podría esperar que el LiCl sea más soluble en acetona que en agua. De hecho, lo opuesto es cierto: 83 g de LiCl se disuelven en 100 ml de agua a 20 ° C, pero solo unos 4,1 g de ( ce {LiCl} ) se disuelven en 100 ml de acetona. Esta aparente contradicción surge del hecho de que el momento dipolar es una propiedad de una sola molécula en la fase gaseosa. Una medida más útil de la capacidad de un disolvente para disolver compuestos iónicos es su constante dieléctrica (ε), que es la capacidad de una sustancia en masa para disminuir las fuerzas electrostáticas entre dos cargas partículas Por definición, la constante dieléctrica de un vacío es 1. En esencia, un solvente con una alta constante dieléctrica hace que las partículas cargadas se comporten como si se hubieran separado más. A 25 ° C, la constante dieléctrica del agua es 80.1, una de las más altas conocidas, y la de acetona es solo 21.0. Por lo tanto, el agua puede disminuir la atracción electrostática entre ( ce {Li ^ {+}} ) y ( ce {Cl ^ {-}} ) iones, entonces ( ce {LiCl} ) Es más soluble en agua que en acetona. Este comportamiento contrasta con el de las sustancias moleculares, para las cuales la polaridad es el factor dominante que gobierna la solubilidad.
La constante dieléctrica de un solvente es la medida más útil de su capacidad para disolver compuestos iónicos. La polaridad de un solvente es el factor dominante en la disolución de sustancias moleculares.
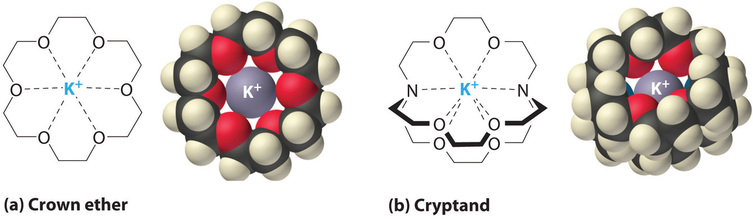
También es posible disolver compuestos iónicos en solventes orgánicos usando éteres corona, compuestos cíclicos con la fórmula general ((OCH_2CH_2) _n ). Los éteres de corona se nombran utilizando tanto el número total de átomos en el anillo como el número de átomos de oxígeno. Por lo tanto, 18-crown-6 es un anillo de 18 miembros con seis átomos de oxígeno (Figura ( PageIndex {1a} )). La cavidad en el centro de la molécula de éter corona está revestida con átomos de oxígeno y es lo suficientemente grande como para ser ocupada por un catión, como (K ^ + ). El catión se estabiliza al interactuar con pares de electrones solitarios en los átomos de oxígeno circundantes. Por lo tanto, los éteres corona solvatan los cationes dentro de una cavidad hidrofílica, mientras que la cubierta externa, que consiste en enlaces CH, es hidrófoba. Los éteres corona son útiles para disolver sustancias iónicas como (KMnO_4 ) en disolventes orgánicos como isopropanol ([(CH_3) _2CHOH] ) (Figura ( PageIndex {5} )). La disponibilidad de éteres corona con cavidades de diferentes tamaños permite soldar cationes específicos con un alto grado de selectividad.

Los criptandos (del griego kryptós, que significa “oculto”) son compuestos que pueden rodear completamente un catión con pares solitarios de electrones en átomos de oxígeno y nitrógeno (Figura ( PageIndex {4b} )). El número en el nombre de la cripta y es el número de átomos de oxígeno en cada cadena de la molécula. Al igual que los éteres corona, los criptandos se pueden usar para preparar soluciones de compuestos iónicos en disolventes que de otro modo serían demasiado no polares para disolverlos.
Resumen
La solubilidad de una sustancia es la cantidad máxima de un soluto que puede disolverse en una cantidad dada de solvente; depende de la naturaleza química del soluto y del solvente y de la temperatura y la presión. Cuando una solución contiene la cantidad máxima de soluto que puede disolverse en un conjunto de condiciones, es una solución saturada. De lo contrario, es insaturado. Las soluciones supersaturadas, que contienen más soluto disuelto que el permitido en condiciones particulares, no son estables; La adición de un cristal semilla, una pequeña partícula de soluto, generalmente hará que el exceso de soluto se cristalice. Un sistema en el que la cristalización y la disolución ocurren a la misma velocidad está en equilibrio dinámico. La solubilidad de una sustancia en un líquido está determinada por las interacciones intermoleculares, que también determinan si dos líquidos son miscibles. Los solutos se pueden clasificar como hidrofílicos (amantes del agua) o hidrófobos (temerosos del agua). Las vitaminas con estructuras hidrofílicas son solubles en agua, mientras que aquellas con estructuras hidrofóbicas son solubles en grasa. Muchos metales se disuelven en mercurio líquido para formar amalgamas. Los sólidos de red covalentes y la mayoría de los metales son insolubles en casi todos los solventes. La solubilidad de los compuestos iónicos está determinada en gran medida por la constante dieléctrica (ε) del solvente, una medida de su capacidad para disminuir las fuerzas electrostáticas entre partículas cargadas. Las soluciones de muchos compuestos iónicos en solventes orgánicos se pueden disolver usando éteres corona, poliéteres cíclicos lo suficientemente grandes como para acomodar un ion metálico en el centro, o criptandos, compuestos que rodean completamente un catión.