Los sólidos cristalinos se dividen en una de cuatro categorías. Las cuatro categorías implican empaquetar moléculas o átomos discretos en una red o matriz repetitiva, aunque los sólidos de red son un caso especial. Las categorías se distinguen por la naturaleza de las interacciones que mantienen unidas las moléculas o átomos discretos. Según la naturaleza de las fuerzas que mantienen unidos a los átomos, moléculas o iones componentes, los sólidos pueden clasificarse formalmente como iónicos, moleculares, covalentes (en red) o metálicos. La variación en las fuerzas relativas de estos cuatro tipos de interacciones se correlaciona muy bien con su amplia variación en las propiedades.
| Tipo de sólido | Interacción | Propiedades | Ejemplos |
|---|---|---|---|
| Iónico | Iónico | Alto punto de fusión, quebradizo, duro | NaCl, MgO |
| Molecular | Enlace de hidrógeno, Dipolo-Dipolo, Dispersión de Londres |
Punto de fusión bajo, no conductor | H 2 , CO 2 |
| Metálico | Enlace metálico | Dureza variable y punto de fusión (dependiendo de la resistencia de la unión metálica), conducción | Fe, Mg |
| Red | Enlace covalente | Alto punto de fusión, duro, no conductor | C (diamante), SiO 2 (cuarzo) |
En los sólidos iónicos y moleculares, no hay enlaces químicos entre las moléculas, los átomos o los iones. El sólido consiste en especies químicas discretas unidas por fuerzas intermoleculares que son electrostáticas o Coulombic en la naturaleza. Este comportamiento es más obvio para un sólido iónico como (NaCl ), donde los iones Na + cargados positivamente son atraídos por los iones (Cl ^ – ) cargados negativamente. Sin embargo, incluso en ausencia de iones, las fuerzas electrostáticas están operativas. Para moléculas polares como (CH_2Cl_2 ), la región cargada positivamente de un molecular se atrae a la región cargada negativamente de otra molécula ( interacciones dipolo-dipolo ). Para una molécula no polar como (CO_2 ), que no tiene un momento dipolar permanente, el movimiento aleatorio de los electrones da lugar a una polaridad temporal (un momento dipolar temporal). Las atracciones electrostáticas entre dos moléculas temporalmente polarizadas se denominan Fuerzas de dispersión de Londres .
Enlace de hidrógeno es un término que describe una interacción atractiva entre un átomo de hidrógeno de una molécula o un fragmento molecular X – H en el que X es más electronegativo que H, y un átomo o un grupo de átomos en la misma molécula o una diferente, en la que hay evidencia de formación de enlaces. (Consulte la Recomendación provisional de la IUPAC sobre la definición de un enlace de hidrógeno). Los puntos se emplean para indicar la presencia de un enlace de hidrógeno: X – H ••• Y. La interacción atractiva en un enlace de hidrógeno típicamente tiene una fuerte contribución electrostática, pero también están presentes fuerzas de dispersión y enlaces covalentes débiles.
En sólidos metálicos y sólidos de red, sin embargo, los enlaces químicos mantienen unidas las subunidades químicas individuales. El cristal es esencial, una molécula macroscópica única con enlaces químicos continuos en toda la estructura. En los sólidos metálicos, los electrones de valencia ya no están asociados exclusivamente con un solo átomo. En cambio, estos electrones existen en orbitales moleculares que se deslocalizan sobre muchos átomos, produciendo una estructura de banda electrónica. El cristal metálico consiste esencialmente en un conjunto de cationes metálicos en un mar de electrones. Este tipo de enlace químico se llama enlace metálico .
Sólidos iónicos
Aprendiste previamente que un sólido iónico consiste en iones cargados positiva y negativamente unidos por fuerzas electrostáticas. La fuerza de las fuerzas atractivas depende de la carga y el tamaño de los iones que componen la red y determina muchas de las propiedades físicas del cristal.
La energía de la red (es decir, la energía requerida para separar 1 mol de un sólido iónico cristalino en sus iones componentes en la fase gaseosa) es directamente proporcional al producto de las cargas iónicas e inversamente proporcional a La suma de los radios de los iones. Por ejemplo, NaF y CaO cristalizan en la estructura de cloruro de sodio cúbico centrado en la cara (fcc), y los tamaños de sus iones componentes son casi iguales: Na + (102 pm) versus Ca 2 + (100 pm), y F – (133 pm) versus O 2− (140 pm). Sin embargo, debido a la mayor carga de los iones en CaO, la energía reticular de CaO es casi cuatro veces mayor que la de NaF (3401 kJ / mol frente a 923 kJ / mol). Las fuerzas que mantienen unido a Ca y O en CaO son mucho más fuertes que las que mantienen unido a Na y F en NaF, por lo que el calor de fusión de CaO es casi el doble que el de NaF (59 kJ / mol versus 33.4 kJ / mol), y El punto de fusión de CaO es 2927 ° C frente a 996 ° C para NaF. En ambos casos, sin embargo, los valores son grandes; es decir, los compuestos iónicos simples tienen altos puntos de fusión y son sólidos relativamente duros (y quebradizos).
Sólidos moleculares
Los sólidos moleculares consisten en átomos o moléculas unidos entre sí por interacciones dipolo-dipolo, fuerzas de dispersión de Londres o enlaces de hidrógeno, o cualquier combinación de estos. La disposición de las moléculas en benceno sólido es la siguiente:
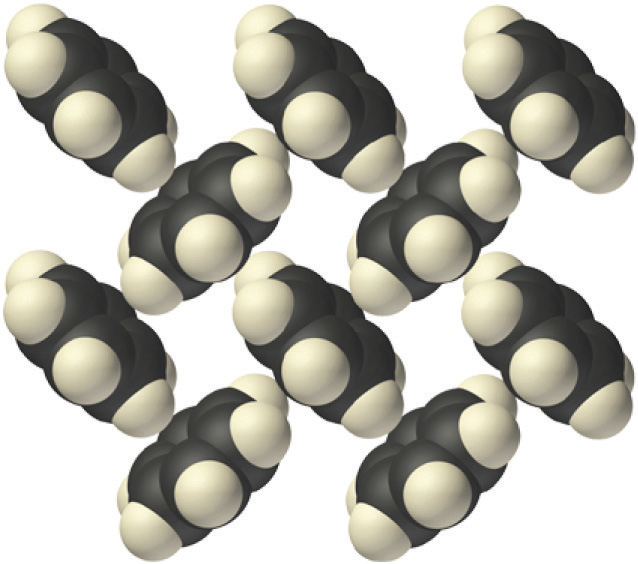
Debido a que las interacciones intermoleculares en un sólido molecular son relativamente débiles en comparación con los enlaces iónicos y covalentes, los sólidos moleculares tienden a ser blandos, de baja fusión y fácilmente vaporizados ( (ΔH_ {fus} ) y (ΔH_ {vap} ) estan bajos). Para sustancias similares, la fuerza de las fuerzas de dispersión de Londres aumenta suavemente con el aumento de la masa molecular. Por ejemplo, los puntos de fusión del benceno (C 6 H 6 ), naftaleno (C 10 H 8 ) y antraceno ( C 14 H 10 ), con uno, dos y tres anillos aromáticos fusionados, son 5.5 ° C, 80.2 ° C y 215 ° C, respectivamente. Las entalpías de fusión también aumentan suavemente dentro de la serie: benceno (9.95 kJ / mol)
El caucho autocurativo es un ejemplo de un sólido molecular con el potencial para aplicaciones comerciales significativas. El material puede estirarse, pero cuando se rompe en pedazos puede volver a unirse mediante el restablecimiento de su red de enlace de hidrógeno sin mostrar ningún signo de debilidad. Entre otras aplicaciones, se está estudiando para su uso en adhesivos y neumáticos de bicicleta que se autocurarán.
Sólidos de red covalentes
Los sólidos covalentes están formados por redes o cadenas de átomos o moléculas unidas por enlaces covalentes. Un cristal único perfecto de un sólido covalente es, por lo tanto, una molécula gigante única. Por ejemplo, la estructura del diamante, que se muestra en la parte (a) en la Figura ( PageIndex {1} ), consiste en átomos de carbono hibridados sp3, cada uno unido a otros cuatro átomos de carbono en una matriz tetraédrica para crear una red gigante. Los átomos de carbono forman anillos de seis miembros.
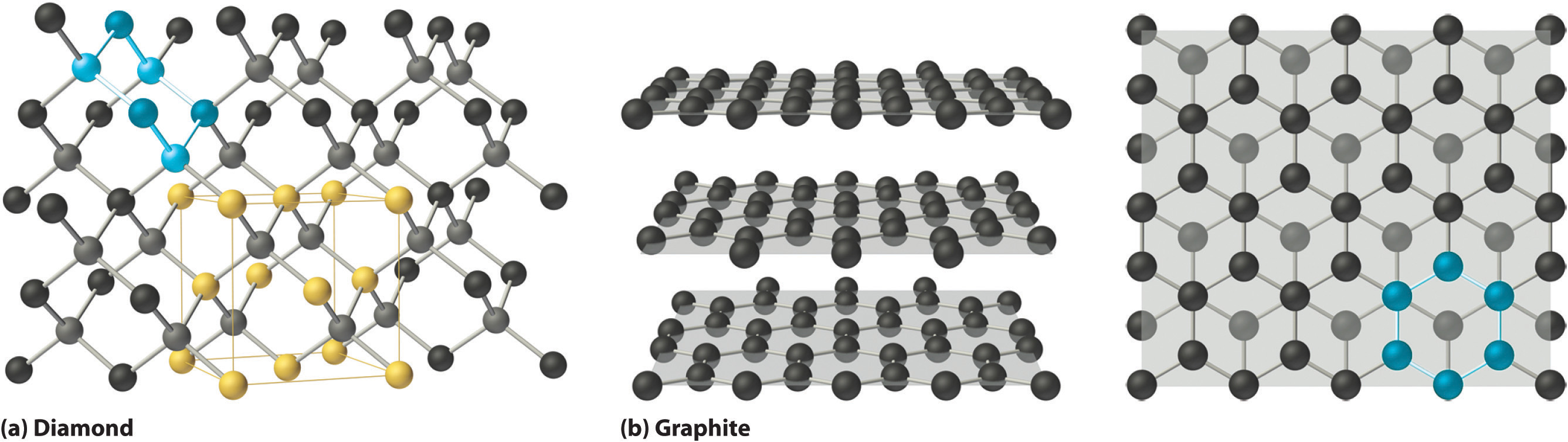
La celda unitaria de diamante se puede describir como una matriz fcc de átomos de carbono con cuatro átomos de carbono adicionales insertados en cuatro de los agujeros tetraédricos. Por lo tanto, tiene la estructura de mezcla de zinc descrita en la Sección 12.3, excepto que en la mezcla de zinc los átomos que componen la matriz fcc son azufre y los átomos en los agujeros tetraédricos son zinc. El silicio elemental tiene la misma estructura, al igual que el carburo de silicio (SiC), que tiene átomos alternos de C y Si. La estructura del cuarzo cristalino (SiO 2 ), que se muestra en la Sección 12.1, puede verse como derivada de la estructura del silicio al insertar un átomo de oxígeno entre cada par de átomos de silicio.
Todos los compuestos con el diamante y las estructuras relacionadas son sólidos duros de alto punto de fusión que no se deforman fácilmente. En cambio, tienden a romperse cuando se someten a grandes tensiones, y generalmente no conducen la electricidad muy bien. De hecho, el diamante (punto de fusión = 3500 ° C a 63.5 atm) es una de las sustancias más duras conocidas, y el carburo de silicio (punto de fusión = 2986 ° C) se usa comercialmente como abrasivo en papel de lija y muelas abrasivas. Es difícil deformar o derretir estos y otros compuestos relacionados porque los enlaces covalentes fuertes (C – C o Si – Si) o covalentes polares (Si – C o Si – O) deben romperse, lo que requiere un gran aporte de energía.
Otros sólidos covalentes tienen estructuras muy diferentes. Por ejemplo, el grafito, el otro alótropo común de carbono, tiene la estructura que se muestra en la parte (b) en la Figura ( PageIndex {1} ). Contiene redes planas de anillos de seis miembros de átomos de carbono hibridados sp2 en los que cada carbono está unido a otros tres. Esto deja un solo electrón en un orbital no hibridado de 2pz que puede usarse para formar enlaces dobles C = C, lo que da como resultado un anillo con enlaces dobles y simples alternos. Debido a sus estructuras de resonancia, la unión en grafito se considera mejor como una red de enlaces simples C-C con un tercio de un enlace π que mantiene unidos los carbonos, de forma similar a la unión en benceno.
Para describir completamente la unión en el grafito, necesitamos un enfoque orbital molecular similar al utilizado para el benceno en el Capítulo 9. De hecho, la distancia C – C en el grafito (141.5 pm) es un poco más larga que la distancia en benceno (139.5 pm), consistente con un orden neto de enlaces carbono-carbono de 1.33. En el grafito, los planos bidimensionales de los átomos de carbono se apilan para formar un sólido tridimensional; solo las fuerzas de dispersión de Londres mantienen unidas las capas. Como resultado, el grafito exhibe propiedades típicas de los sólidos covalentes y moleculares. Debido al fuerte enlace covalente dentro de las capas, el grafito tiene un punto de fusión muy alto, como se esperaba para un sólido covalente (en realidad se sublima a aproximadamente 3915 ° C). También es muy suave; las capas pueden deslizarse fácilmente entre sí debido a las débiles interacciones entre capas. En consecuencia, el grafito se usa como lubricante y como “plomo” en los lápices; La fricción entre el grafito y un trozo de papel es suficiente para dejar una fina capa de carbón sobre el papel. El grafito es inusual entre los sólidos covalentes, ya que su conductividad eléctrica es muy paralela a los planos de los átomos de carbono debido a la unión desocalizada de C – C π. Finalmente, el grafito es negro porque contiene una inmensa cantidad de dobles enlaces alternos, lo que resulta en una muy pequeña diferencia de energía entre los orbitales moleculares individuales. Por lo tanto, se absorbe la luz de prácticamente todas las longitudes de onda. El diamante, por otro lado, es incoloro cuando es puro porque no tiene electrones deslocalizados. La tabla ( PageIndex {2} ) compara las fuerzas de las interacciones intermoleculares e intramoleculares para tres sólidos covalentes, mostrando la debilidad comparativa de las interacciones entre capas.
| Sustancia | ΔH sub (kJ / mol) | Energía media de bonos (kJ / mol) |
|---|---|---|
| fósforo (s) | 58,98 | 201 |
| azufre (s) | 64,22 | 226 |
| yodo (s) | 62,42 | 149 |
Carbono: un ejemplo de un sólido de red covalente
En los sólidos de la red, los enlaces químicos convencionales mantienen unidas las subunidades químicas. Sin embargo, la unión entre las subunidades químicas es idéntica a la de las subunidades, lo que da como resultado una red continua de enlaces químicos. Un ejemplo común de sólidos de red es el diamante (una forma de carbono puro). El carbono existe como elemento puro a temperatura ambiente en tres formas diferentes: grafito (la forma más estable), diamante y fullereno.
Diamantes
La estructura del diamante se muestra a la derecha en un formato de “bola y palo”. Las bolas representan los átomos de carbono y las barras representan un enlace covalente. Tenga en cuenta que en la representación de “bola y palo” el tamaño de las bolas no representa con precisión el tamaño de los átomos de carbono. Además, se dibuja un solo palo para representar un enlace covalente independientemente de si el enlace es un enlace simple, doble o triple o requiere estructuras de resonancia para representar. En la estructura de diamante, todos los enlaces son enlaces covalentes simples ( ( sigma ) enlaces). El formato de “relleno de espacio” es una representación alternativa que muestra los átomos como esferas con un radio igual al radio de Van der Waals, lo que proporciona una mejor idea del tamaño de los átomos.
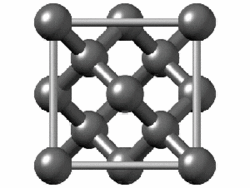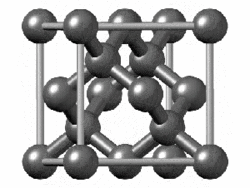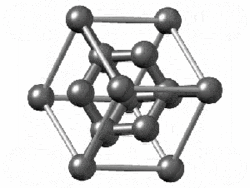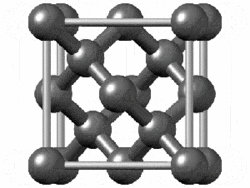
Observe que el diamante es un sólido de red. Todo el sólido es una repetición “interminable” de átomos de carbono unidos entre sí por enlaces covalentes. (En la pantalla de la derecha, la estructura se trunca para que quepa en el área de la pantalla).
Grafito
La forma más estable de carbono es el grafito. El grafito consiste en láminas de átomos de carbono unidos covalentemente. Estas hojas se apilan para formar grafito. La Figura ( PageIndex {3} ) muestra una representación de grafito de bola y palo con hojas que se extienden “indefinidamente” en el plano xy, pero la estructura se ha truncado para su visualización. El grafito también puede considerarse como un sólido de red, aunque no haya enlaces en la dirección z. Sin embargo, cada capa es una red unida “interminable” de átomos de carbono.
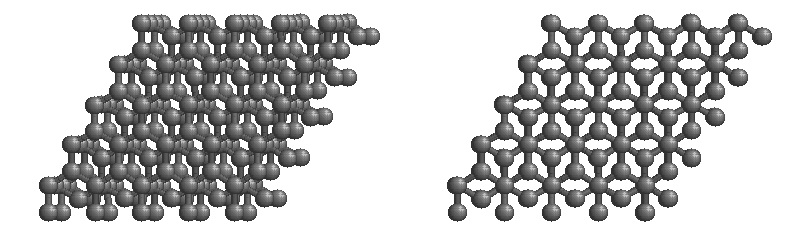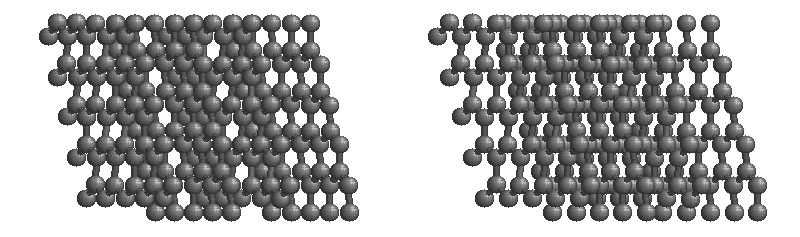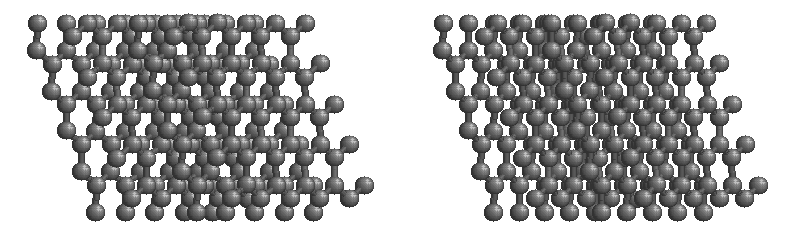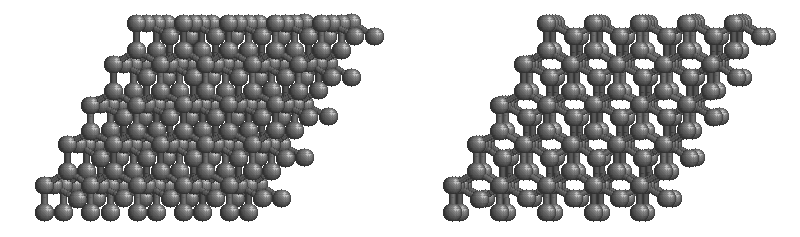
Fullerenos
Hasta mediados de la década de 1980, se pensaba que el carbono puro existía en dos formas: grafito y diamante. El descubrimiento de moléculas de C 60 en polvo interestelar en 1985 agregó una tercera forma a esta lista. La teoría de la existencia de C 60 , que se asemeja a un balón de fútbol, había sido formulada por los teóricos durante muchos años. A fines de la década de 1980, se desarrollaron métodos sintéticos para la síntesis de C 60 , y la disponibilidad inmediata de esta forma de carbono condujo a una extensa investigación sobre sus propiedades.
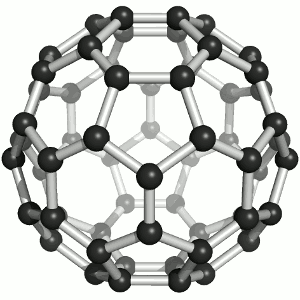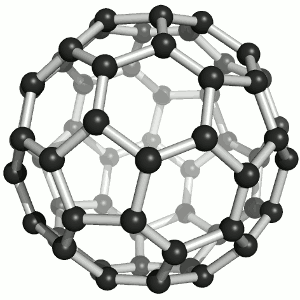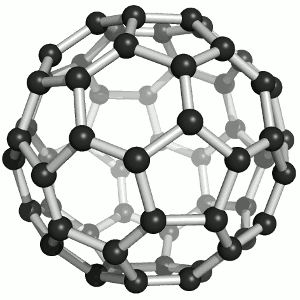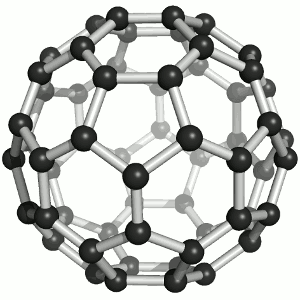
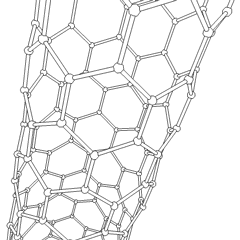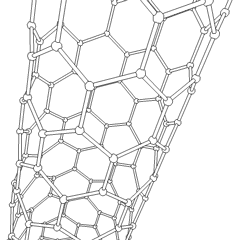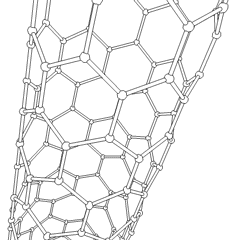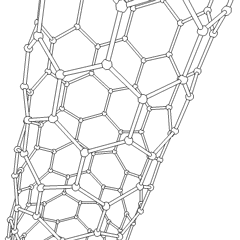
La molécula C 60 (Figura ( PageIndex {4} ); izquierda), se llama buckminsterfullereno, aunque a menudo se usa el nombre más corto de fullereno. El nombre es un homenaje al arquitecto estadounidense R. Buckminster Fuller, famoso por diseñar y construir cúpulas geodésicas que tienen una gran similitud con la estructura de C 60 . Como es evidente en la pantalla, C 60 es una esfera compuesta de anillos de carbono de seis y cinco miembros. Estas bolas a veces se conocen con cariño como “bolas Bucky”. Cabe señalar que los fullerenos son una clase completa de compuestos de carbono puro en lugar de un solo compuesto. También se ha encontrado una esfera distorsionada que contiene más de 60 átomos de carbono, y también es posible crear tubos largos (Figura ( PageIndex {4} ); derecha). Todas estas sustancias son carbono puro.
Sólidos metálicos
Los sólidos metálicos como los cristales de cobre, aluminio y hierro están formados por átomos metálicos Figura ( PageIndex {5} ). La estructura de los cristales metálicos a menudo se describe como una distribución uniforme de núcleos atómicos dentro de un “mar” de electrones deslocalizados. Los átomos dentro de dicho sólido metálico se mantienen unidos por una fuerza única conocida como unión metálica que da lugar a muchas propiedades de volumen útiles y variadas. Todos exhiben alta conductividad térmica y eléctrica, brillo metálico y maleabilidad. Muchos son muy duros y bastante fuertes. Debido a su maleabilidad (la capacidad de deformarse bajo presión o martilleo), no se rompen y, por lo tanto, son materiales de construcción útiles.
Los metales se caracterizan por su capacidad para reflejar la luz, llamada brillo, su alta conductividad eléctrica y térmica, su alta capacidad térmica y su maleabilidad y ductilidad. Cada punto de la red en un elemento metálico puro está ocupado por un átomo del mismo metal. La eficiencia de empaquetamiento en los cristales metálicos tiende a ser alta, por lo que los sólidos metálicos resultantes son densos, y cada átomo tiene hasta 12 vecinos más cercanos.
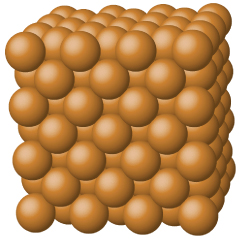
La unión en sólidos metálicos es bastante diferente de la unión en los otros tipos de sólidos que hemos discutido. Debido a que todos los átomos son iguales, no puede haber enlaces iónicos, pero los metales siempre contienen muy pocos electrones u orbitales de valencia para formar enlaces covalentes con cada uno de sus vecinos. En cambio, los electrones de valencia se deslocalizan en todo el cristal, proporcionando una fuerte fuerza cohesiva que mantiene unidos a los átomos de metal.
Los electrones de valencia en un sólido metálico se deslocalizan, proporcionando una fuerte fuerza cohesiva que mantiene unidos a los átomos.
La fuerza de los enlaces metálicos varía dramáticamente. Por ejemplo, el cesio se derrite a 28.4 ° C, y el mercurio es un líquido a temperatura ambiente, mientras que el tungsteno se derrite a 3680 ° C. Los enlaces metálicos tienden a ser más débiles para elementos que tienen subcapas de valencia casi vacías (como en Cs) o casi completas (Hg), y más fuertes para elementos con capas de valencia aproximadamente llenas hasta la mitad (como en W). Como resultado, los puntos de fusión de los metales aumentan al máximo alrededor del grupo 6 y luego disminuyen nuevamente de izquierda a derecha a través del bloque d. Otras propiedades relacionadas con la resistencia de los enlaces metálicos, como las entalpías de fusión, los puntos de ebullición y la dureza, tienen tendencias periódicas similares.
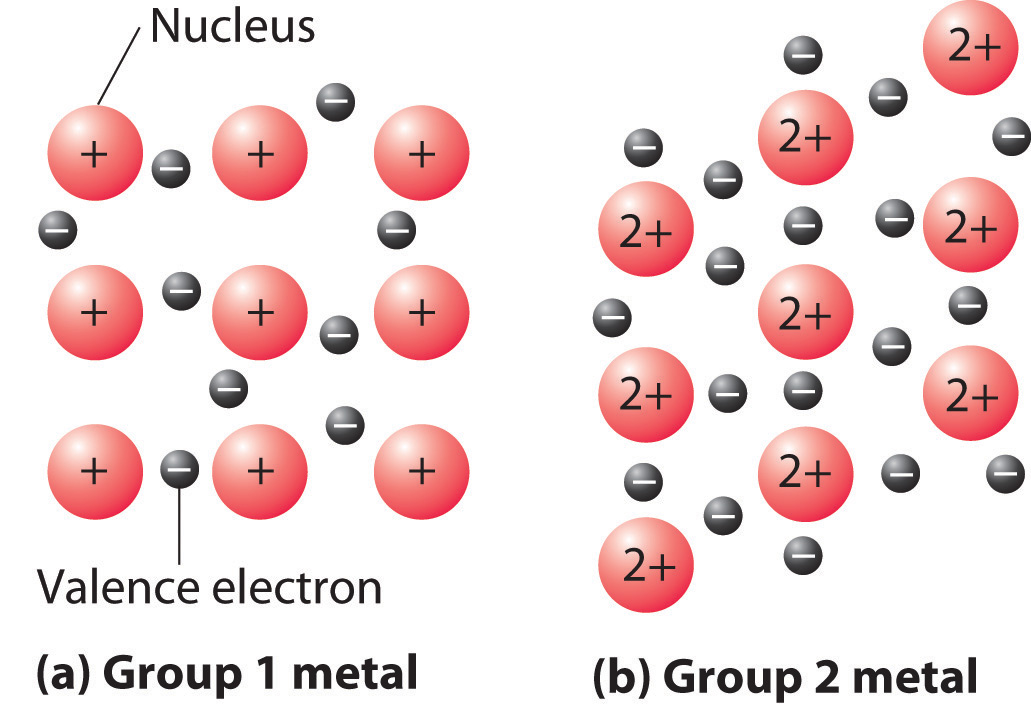
Una forma algo simplificada de describir el enlace en un cristal metálico es representar el cristal como un núcleo cargado positivamente en un mar de electrones (Figura ( PageIndex {6} )). En este modelo, los electrones de valencia no están fuertemente unidos a ningún átomo, sino que se distribuyen uniformemente por toda la estructura. Se necesita muy poca energía para eliminar los electrones de un metal sólido porque no están unidos a un solo núcleo. Cuando se aplica un potencial eléctrico, los electrones pueden migrar a través del sólido hacia el electrodo positivo, produciendo así una alta conductividad eléctrica. La facilidad con la que los metales pueden deformarse bajo presión se atribuye a la capacidad de los iones metálicos para cambiar de posición dentro del mar de electrones sin romper ningún enlace específico. La transferencia de energía a través del sólido por sucesivas colisiones entre los iones metálicos también explica la alta conductividad térmica de los metales. Sin embargo, este modelo no explica muchas de las otras propiedades de los metales, como su brillo metálico y las tendencias observadas en la resistencia de la unión que se reflejan en los puntos de fusión o entalpías de fusión. Algunas propiedades generales de las cuatro clases principales de sólidos se resumen en la Tabla ( PageIndex {2} ).
| Sólidos iónicos | Sólidos moleculares | Sólidos covalentes | Sólidos metálicos |
|---|---|---|---|
| * Existen muchas excepciones. Por ejemplo, el grafito tiene una conductividad eléctrica relativamente alta dentro de los planos de carbono, y el diamante tiene la conductividad térmica más alta de cualquier sustancia conocida. | |||
| malos conductores de calor y electricidad | malos conductores de calor y electricidad | malos conductores de calor y electricidad * | buenos conductores de calor y electricidad |
| punto de fusión relativamente alto | bajo punto de fusión | alto punto de fusión | los puntos de fusión dependen en gran medida de la configuración electrónica |
| duro pero quebradizo; romperse bajo tensión | suave | muy duro y quebradizo | se deforma fácilmente bajo tensión; dúctil y maleable |
| relativamente denso | baja densidad | baja densidad | generalmente de alta densidad |
| superficie opaca | superficie opaca | superficie opaca | brillante |
Resumen
Los principales tipos de sólidos son iónicos, moleculares, covalentes y metálicos. Los sólidos iónicos consisten en iones cargados positiva y negativamente unidos por fuerzas electrostáticas; La fuerza de la unión se refleja en la energía de la red. Los sólidos iónicos tienden a tener altos puntos de fusión y son bastante duros. Los sólidos moleculares se mantienen unidos por fuerzas relativamente débiles, como las interacciones dipolo-dipolo, los enlaces de hidrógeno y las fuerzas de dispersión de Londres. Como resultado, tienden a ser bastante suaves y tienen bajos puntos de fusión, que dependen de su estructura molecular. Los sólidos covalentes consisten en redes de átomos bidimensionales o tridimensionales unidas por enlaces covalentes; tienden a ser muy duros y tienen altos puntos de fusión. Los sólidos metálicos tienen propiedades inusuales: además de tener una alta conductividad térmica y eléctrica y de ser maleables y dúctiles, exhiben brillo, una superficie brillante que refleja la luz. Una aleación es una mezcla de metales que tiene propiedades metálicas a granel diferentes de las de sus elementos constituyentes. Las aleaciones pueden formarse sustituyendo un átomo metálico por otro de tamaño similar en la red (aleaciones sustitucionales), insertando átomos más pequeños en agujeros en la red metálica (aleaciones intersticiales), o mediante una combinación de ambos. Aunque la composición elemental de la mayoría de las aleaciones puede variar en amplios intervalos, ciertos metales se combinan solo en proporciones fijas para formar compuestos intermetálicos con propiedades únicas.
Colaboradores
-
Mike Blaber ( Florida State University )
-
Prof. David Blauch ( Davidson College )
-
Paul Flowers (University of North Carolina – Pembroke), Klaus Theopold (University of Delaware) and Richard Langley (Stephen F. Austin State University) with contributing authors. Textbook content produced by OpenStax College is licensed under a Creative Commons Attribution License 4.0 license. Download for free at http://cnx.org/contents/85abf193-2bd…a7ac8df6@9.110 ).