¿Qué es la calorimetría de reacción?

La calorimetría es una ciencia que persigue la teoría y las mediciones del calor liberado o absorbido por un sistema causado por reacciones químicas, cambios físicos, transiciones de fase y demás. Calorimetría de reacción es un subtipo de calorimetría que se especializa en medir la energía liberada o absorbida durante las reacciones químicas.
En pocas palabras, la calorimetría de reacción es una disciplina que permite a los químicos realizar análisis térmicos y cinéticos de su proceso deseado en pequeñas escalas (por ejemplo, permitiendo la simulación de escenarios de falla de forma segura) y bajo condiciones realistas (agitación, temperatura, presión, rampas de dosificación, etc.).
Una breve historia de la calorimetría
La palabra calorimetría proviene del latín “Calor” (calor) y “Métron” (medida).
El médico y químico escocés, Joseph Black (1728-1799) , es considerado como el fundador de la ciencia de la calorimetría, ya que fue el primero en reconocer una diferencia entre el calor y la temperatura.
La primera persona que sentó una base sólida para la calorimetría fue Antoine Lavoisier (1743-1794) , a menudo considerado como el padre de la química moderna. Construyó el primer dispositivo para medir el intercambio de calor en 1782 con su colega, Pierre-Simon Laplace. El dispositivo fue diseñado para medir el calor involucrado en varios cambios químicos (figura 1). El diseño se basó en cálculos y descubrimientos que Joseph Black publicó unos años antes. Los experimentos realizados con este dispositivo se consideran la base de la termoquímica.
Los experimentos con el dispositivo confirmaron la ley de Lavoisier y Laplace de la termoquímica que sentó las bases para la comprensión moderna de la energía y fue fundamental para definir la Primera Ley de la Termodinámica (la energía total de un sistema aislado es constante; se puede transformar en diferentes formas pero no se puede crear ni destruir).
¿Cómo puede ayudar la calorimetría de reacción y dónde encaja?
En los últimos 40 años, la calorimetría de reacción se ha convertido en una herramienta invaluable para los químicos del proceso y los ingenieros químicos para determinar la cinética de la reacción y optimizar las reacciones conocidas (perfiles de dosificación, temperaturas del proceso, etc.), mientras que lo más importante es la determinación de la seguridad del proceso, especialmente cuando se amplía la producción.
En general, los datos de calorimetría de reacción deberían estar disponibles antes de trasladar el desarrollo de un proceso químico a una escala mayor (escala Kilo / planta piloto). Los datos obtenidos proporcionarán el perfil de flujo de calor de la reacción, sobre el cual se debe construir el diseño del experimento / proceso de producción a mayor escala para ejecutar el proceso en condiciones seguras. Con más pruebas, la calorimetría de reacción permite el desarrollo de protocolos de emergencia para fallas durante la fabricación a gran escala, a través de la simulación del proceso en una escala más pequeña, que es más fácil y seguro de controlar. Esta forma de pruebas adicionales puede ayudar a la industria a evitar desastres industriales como la explosión e incendio de T2 Laboratories donde la falta de protocolos de falla resultó en una fuga térmica en el reactor.
Sin embargo, este no es el único enfoque. Inicialmente, el análisis de seguridad fue la razón principal por la que se desarrolló la técnica, pero se puede aplicar en orden inverso: los químicos pueden reducir los procesos existentes y optimizarlos (por ejemplo, al cambiar de proveedores de productos químicos), para lograr una mayor eficiencia en la producción. Esta técnica se usa rutinariamente para procesos de semilotes, sin embargo, se puede adaptar para ser utilizada en procesos de flujo continuo o discontinuo puro.
En escenarios de desarrollo de procesos estándar, los análisis de calorimetría de reacción tienen lugar durante la identificación de rutas sintéticas y luego durante la optimización de la ruta seleccionada. La calorimetría de reacción generalmente irá acompañada de un análisis térmico (que determina la estabilidad térmica de los componentes / productos), para establecer el proceso más eficiente y seguro.
Calorímetros de reacción: ¿cómo funcionan?
Es posible dividir los calorímetros de reacción en cuatro grupos, dependiendo de la técnica de medición utilizada:
1. Calorímetros de flujo de calor (HFC)
El primer calorímetro de reacción especializado se diseñó alrededor del principio del flujo de calor, y todavía se considera un estándar de la industria hasta el día de hoy. El recipiente de medición es esencialmente un reactor con camisa, y las señales de las sondas de temperatura se usan para calcular el flujo de calor a través de la pared del reactor, utilizando la siguiente ecuación (en condiciones de estado estacionario):
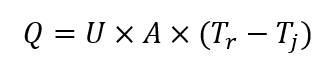
Donde: Q es la tasa de transferencia de calor [W]; U es el coeficiente global de transferencia de calor [W (m 2 K) -1 ]; A es el área de transferencia de calor [m 2 ]; T r es la temperatura del proceso; T j es la temperatura de la camisa del reactor.
Esta técnica tiene una gran desventaja. Como U y A pueden cambiar durante el experimento, es necesario realizar una calibración para determinar la UA antes y después del experimento. Cuando se conoce UA, los datos se procesan utilizando los valores obtenidos para corregirlo. La UA se determina mediante el uso de un calentador de calibración de potencia conocida.
Esto significa que este método tiene un uso limitado cuando UA cambia considerablemente (cambio de viscosidad, densidad, volumen de llenado del reactor). Esos cambios a menudo no son lineales y son muy difíciles de corregir (mediciones de par, etc.). Dichas correcciones son normalmente suficientes para estudios de seguridad, sin embargo, los calorímetros de flujo de calor luchan cuando se observan grandes cambios de UA. Debido a los pulsos de calibración, el método no puede proporcionar datos en tiempo real (ya que luego se corrigen utilizando el UA obtenido de la calibración).
El flujo de trabajo típico del calorímetro isotérmico de flujo de calor es el siguiente:
- Alcanzar la temperatura de reacción deseada usando el circulador y alcanzar condiciones de estado estable
- Realice el pulso de precalibración usando un calentador de calibración para determinar el valor inicial de UA
- Después, la reacción tiene lugar con las condiciones de proceso deseadas (adiciones, etc.)
- Pulso posterior a la calibración para determinar el valor final de UA
- Procesamiento de datos, interpolando los valores de UA (hecho automáticamente), y calculando la entalpía específica de la reacción (kJ), y calculando el valor escalable (kJ mol -1 ).
Con un aparato más avanzado, el HFC se puede realizar de forma no isotérmica o bajo reflujo con un condensador especializado, generalmente con menor precisión y un esfuerzo significativo al interpretar los datos.
La calorimetría de flujo de calor isotérmico es el estándar de la industria para estudios de seguridad y es uno de los modos de operación que ofrece el Calorímetro Syrris Atlas HD . Los resultados obtenidos por la calorimetría de flujo de calor isotérmico se consideran lo suficientemente precisos para la mayoría de los estudios básicos de calorimetría de reacción (por ejemplo, reacciones monofásicas), pero para aplicaciones donde se requiere una mayor precisión (por ejemplo, estudiar explosivos y propulsores), sus limitaciones significan que se requiere un método más preciso ( calorimetría de flujo de calor verdadero, explicada a continuación ).
Descubra el calorímetro de reacción Atlas HD aquí
2. Calorímetros de potencia compensada
La calorimetría de compensación de potencia (PCC) es el otro método generalizado de realizar calorimetría de reacción: es una variación de la calorimetría de flujo de calor (HFC). La medición de potencia se determina mediante la siguiente ecuación simplificada (en condiciones de estado estacionario):
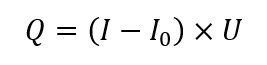
Donde: Q es la tasa de transferencia de calor [W]; I es la corriente suministrada al calentador [A]; I 0 es la corriente suministrada al calentador en condiciones estables antes del experimento [A], U es el voltaje suministrado al calentador [V].
El sistema utiliza una camisa de enfriamiento con flujo y temperatura constantes del refrigerante, que generalmente se establece entre 5 y 20 ° C por debajo de la temperatura de proceso deseada. La temperatura del proceso es mantenida por el calentador eléctrico con una gran superficie. A medida que cambia la carga de calor de la reacción, la potencia del calentador se controla para mantener las condiciones isotérmicas, por lo que la potencia inversa suministrada al calentador es igual al calor generado / absorbido por el sistema de reacción en el recipiente.
La principal ventaja de este método es que no requiere calibración, ya que el calentador de potencia conocida se usa para controlar la temperatura de la reacción, muestra datos en tiempo real y, por lo general, el sistema puede lograr una temperatura térmica más rápida respuesta, ya que el calentamiento basado en electricidad responderá más rápido que un sistema basado en aceite.
La principal desventaja (dependiente del experimento) de la calorimetría de compensación de potencia es la creación de puntos calientes creados por el calentador; estos dan como resultado gradientes de temperatura alrededor del calentador que pueden conducir al inicio local de reacciones. La calorimetría de compensación de potencia también es sensible a los cambios en la UA (como lo es la calorimetría de flujo de calor), y la exotermia máxima está limitada por la potencia disponible del calentador.
Flujo de trabajo típico de un experimento de calorimetría de compensación de potencia (donde no se considera el cambio de UA):
- Calefacción: alcance la temperatura deseada con el calentador (alta potencia constante) y el circulador en
- Establecimiento: una vez que se alcanza la temperatura deseada, el calentador permanece en potencia constante y el circulador controla la temperatura para alcanzar condiciones de estado estable
- Puesta a cero: la temperatura del circulador es fija y la potencia del calentador varía para mantener el reactor a la temperatura deseada
- La reacción tiene lugar con las condiciones de proceso deseadas (adiciones, etc.), mientras que la exotermia se controla variando la potencia del calentador. El valor inverso de la potencia del calentador muestra la potencia de reacción real
- Procesamiento de datos
Los cambios de UA en su mayoría no se abordan con este método: si el experimento se ejecuta con un cambio significativo de UA, es posible ejecutarlo en modo HFC, ya que la mayoría de los instrumentos PCC permiten ejecutarlo sin cambios significativos en el sistema.
La calorimetría de compensación de potencia es un método utilizado para reacciones simples (por ejemplo, donde se puede calcular la exotermia antes / o se conoce) y es uno de los modos de operación ofrecidos por el Calorímetro Syrris Atlas HD .
Descubra el calorímetro de reacción Atlas HD aquí
3. Calorimetría de equilibrio térmico
La calorimetría de equilibrio térmico es ligeramente diferente, ya que utiliza los datos obtenidos del flujo de la camisa para calcular la liberación / absorción de calor. La diferencia entre la temperatura del refrigerante que entra y sale de la camisa se usa para calcular el intercambio de calor. El calor generado / absorbido por el sistema en condiciones de estado estable es el siguiente:
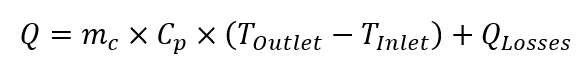
Donde:: Q es la tasa de transferencia de calor [W]; mc es el flujo másico del refrigerante [kg s -1 ]; Cp si la capacidad calorífica específica del refrigerante a la temperatura dada [J (kg K) -1 ], T salida es la temperatura de salida del refrigerante [K], T entrada [ 19459027] es la temperatura de entrada del refrigerante [K], Q las pérdidas son pérdidas térmicas para el medio ambiente [W].
Este método no se usa muy a menudo en la calorimetría de reacción, pero es muy valioso en los accesorios, ya que este principio se usa con condensadores de reflujo utilizados en la calorimetría de reacción, para calcular la potencia de enfriamiento del condensador. Sin embargo, generalmente requiere mayores exotermas (para crear el gradiente de temperatura entre la entrada / salida de la chaqueta) y es muy sensible a la pérdida de calor para el medio ambiente, lo que puede ser difícil de determinar. Sin embargo, en comparación con PCC y HFC, generalmente no se ve afectado por los cambios en la UA.
4. Calorimetría de flujo de calor verdadero
El principio del flujo de calor verdadero puede considerarse como un principio de calorimetría de reacción de 2 y generación, ya que elimina la mayoría de las deficiencias de los métodos descritos anteriormente. La principal diferencia entre la calorimetría de flujo de calor verdadero y otras formas de calorimetría de reacción es una construcción de recipiente de reactor diferente, que no utiliza aceite como medio de control de temperatura. Es una solución única, utilizada exclusivamente por Chemisens CPA 200 calorímetros serie .
La principal diferencia en el reactor es que el control de temperatura se logra mediante el uso del elemento Peltier, que controla la temperatura en el reactor a través de su base metálica. La base metálica contiene un transductor de flujo de calor y, dado que es el área única y bien definida donde se logra la transferencia de calor entre el contenido del reactor y el medio ambiente, no es muy susceptible a los cambios en la UA.
El calor medido utilizando este principio sigue esta ecuación:
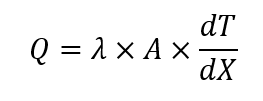
Donde Q es la velocidad de transferencia de calor [W]; λ es la conductividad térmica del transductor de flujo de calor [W (m K) -1 ]; A es el área del transductor de flujo de calor [m 2 ] y dT / dX es el gradiente de temperatura medido sobre el disco del transductor [K m -1 ].
A partir de la ecuación, es visible que ninguno de los parámetros depende del contenido del reactor y no cambia durante el experimento; Esto elimina muchas deficiencias de los métodos anteriores e introduce ventajas sobre ellos. Para un nivel adicional de precisión, todo el reactor se coloca dentro en un baño líquido con control de temperatura preciso, que se mantiene a la misma temperatura que el reactor.
Una ventaja importante de la calorimetría de flujo de calor verdadero es que el reactor no requiere calibración de rutina; El reactor se calibra durante el proceso de fabricación.
Un beneficio importante de la calorimetría de flujo de calor real para el usuario es que la línea de base no cambia durante el transcurso del experimento (como con otros métodos debido a cambios en la UA), por lo que no se ve afectada por cambios en la viscosidad, volumen de llenado, etc., y ofrece un mayor nivel de precisión y sensibilidad (resolución de hasta 0,0001W para el Chemisens HighSens Calorimeter ).
El calorímetro de reacción Syrris Chemisens CPA201 y CPA202 utiliza el verdadero principio de flujo de calor , lo que los convierte en los calorímetros de reacción más precisos y sofisticados disponibles.
Descubre el rango del calorímetro de reacción de Chemisens aquí
Un resumen de los principales tipos de técnicas de reacción de calorimetría
| Principio de calorimetría de reacción | Ventajas | Desventajas |
|---|---|---|
| Calorimetría de flujo de calor (HFC) | • Estándar de la industria, bien entendido en la comunidad • Puede hacer frente a grandes exotermas |
• Requiere pulsos de calibración para la determinación de UA • No adecuado para experimentos con un cambio considerable de UA (viscosidad, cambios de volumen) • Experimentos largos • Respuesta térmica más lenta |
| Calorimetría de compensación de potencia (PCC) | • Respuesta térmica rápida • No se necesita calibración |
• No es adecuado para experimentos con un cambio considerable de UA (viscosidad, cambios de volumen) • La posibilidad de puntos calientes (inicio de reacción local) • Exotermia máxima limitada a la potencia del calentador disponible |
| Calorimetría de equilibrio térmico (HBC) | • Insensible a los cambios en UA | • Por lo general, el gradiente entre la entrada / salida del refrigerante es muy pequeño, presentando un gran margen de error |
| Calorimetría de flujo de calor verdadero (THF) | • No se necesita calibración • Flujo de calor verdadero medido in situ en tiempo real (lo que ves es lo que obtienes) • Insensible a los cambios en UA • Excelente para grandes exotermas • Excelente sensibilidad para procesos de baja entalpía • Capacidad para manejar volúmenes bajos, reacciones multifase y modos no isotérmicos • Debido a la menor cantidad de reactivos necesarios, operación más segura |
• N / A |