Las abundancias relativas de los elementos en el universo conocido varían en más de 12 órdenes de magnitud. En su mayor parte, estas diferencias en abundancia no pueden explicarse por diferencias en la estabilidad nuclear. Aunque el núcleo 56 Fe es el núcleo más estable conocido, el elemento más abundante en el universo conocido no es el hierro, sino el hidrógeno ( 1 H), que representa aproximadamente el 90% de Todos los átomos. De hecho, 1 H es la materia prima a partir de la cual se forman todos los demás elementos. En esta sección, explicamos por qué 1 H y 2 Juntos representan al menos el 99% de todos los átomos en el universo conocido. También describimos las reacciones nucleares que tienen lugar en las estrellas, que transforman un núcleo en otro y crean todos los elementos naturales.
Abundancias relativas de los elementos en la Tierra y en el universo conocido
Las abundancias relativas de los elementos en el universo conocido y en la Tierra en relación con el silicio se muestran en Figura ( PageIndex {1} ) . Los datos son estimaciones basadas en los espectros de emisión característicos de los elementos en las estrellas, los espectros de absorción de materia en las nubes de polvo interestelar y la composición aproximada de la Tierra medida por los geólogos. Los datos en Figura ( PageIndex {1} ) ilustran dos puntos importantes. Primero, a excepción del hidrógeno, los elementos más abundantes tienen incluso números atómicos. Esto no solo es consistente con las tendencias conocidas en estabilidad nuclear, sino que también sugiere que los elementos más pesados se forman combinando núcleos de helio (Z = 2). Segundo, las abundancias relativas de los elementos en el universo conocido y en la Tierra a menudo son muy diferentes, como lo indican los datos en la Tabla ( PageIndex {1} ) para algunos elementos comunes.
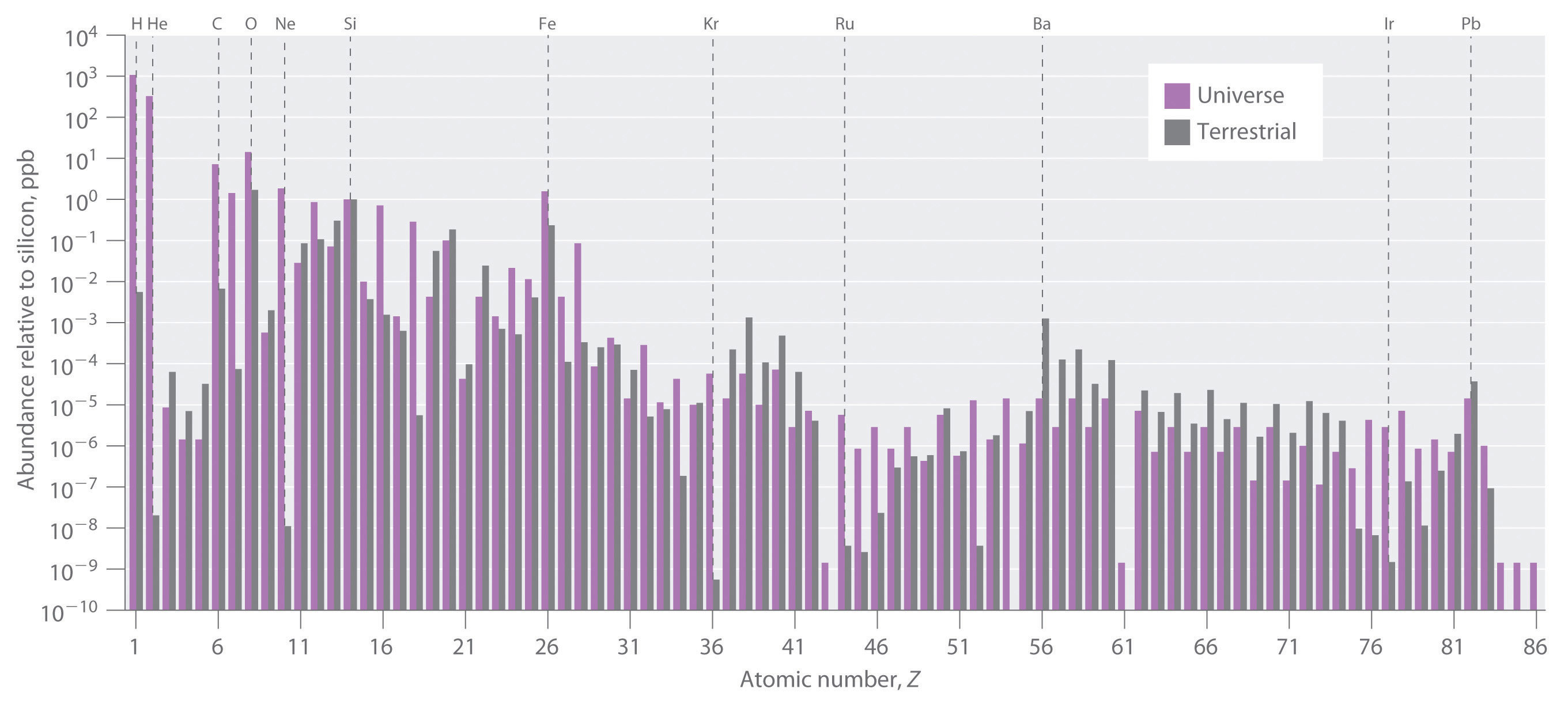
Algunas de estas diferencias se explican fácilmente. Por ejemplo, los no metales como H, He, C, N, O, Ne y Kr son mucho menos abundantes en relación con el silicio en la Tierra que en el resto del universo. Estos elementos son gases nobles (He, Ne y Kr) o elementos que forman hidruros volátiles, como NH 3 , CH 4 y H 2 O. Debido a que la gravedad de la Tierra no es lo suficientemente fuerte como para contener tales sustancias ligeras en la atmósfera, estos elementos se han difundido lentamente en el espacio exterior desde que se formó nuestro planeta. El argón es una excepción; es relativamente abundante en la Tierra en comparación con los otros gases nobles porque se produce continuamente en las rocas por la desintegración radiactiva de isótopos como 40 K. En contraste, muchos metales, como Al, Na, Fe, Ca, Mg, K y Ti son relativamente abundantes en la Tierra porque forman compuestos no volátiles, como los óxidos, que no pueden escapar al espacio. Sin embargo, otros metales son mucho menos abundantes en la Tierra que en el universo; Algunos ejemplos son Ru e Ir. Esta sección explica algunas de las razones de las grandes diferencias en la abundancia de los elementos metálicos.
| Elemento terrestre / universal | Ratio de abundancia |
|---|---|
| H | 0,0020 |
| Él | 2,4 × 10 −8 |
| C | 0,36 |
| N | 0,02 |
| O | 46 |
| Ne | 1,9 × 10 −6 |
| Na | 1200 |
| Mg | 48 |
| Al | 1600 |
| Si | 390 |
| S | 0,84 |
| K | 5000 |
| Ca | 710 |
| Ti | 2200 |
| Fe | 57 |
Todos los elementos originalmente presentes en la Tierra (y en otros planetas) fueron sintetizados a partir de núcleos de hidrógeno y helio en el interior de las estrellas que hace mucho tiempo explotaron y desaparecieron. Seis de los elementos más abundantes en el universo (C, O, Ne, Mg, Si y Fe) tienen núcleos que son múltiplos integrales del núcleo de helio-4, lo que sugiere que el helio-4 es el bloque de construcción principal para núcleos más pesados. .
Síntesis de los elementos en las estrellas
Los elementos se sintetizan en etapas discretas durante la vida útil de una estrella, y algunos pasos ocurren solo en las estrellas más masivas conocidas ( Figura ( PageIndex {2} ) ). Inicialmente, todas las estrellas están formadas por la agregación de “polvo” interestelar, que es principalmente hidrógeno. A medida que la nube de polvo se contrae lentamente debido a la atracción gravitacional, su densidad eventualmente alcanza aproximadamente 100 g / cm 3 , y la temperatura aumenta a aproximadamente 1.5 × 10 7 K, formando una densidad densa. plasma de núcleos de hidrógeno ionizado. En este punto, comienzan las reacciones nucleares autosostenibles, y la estrella “se enciende”, creando una estrella amarilla como nuestro sol.
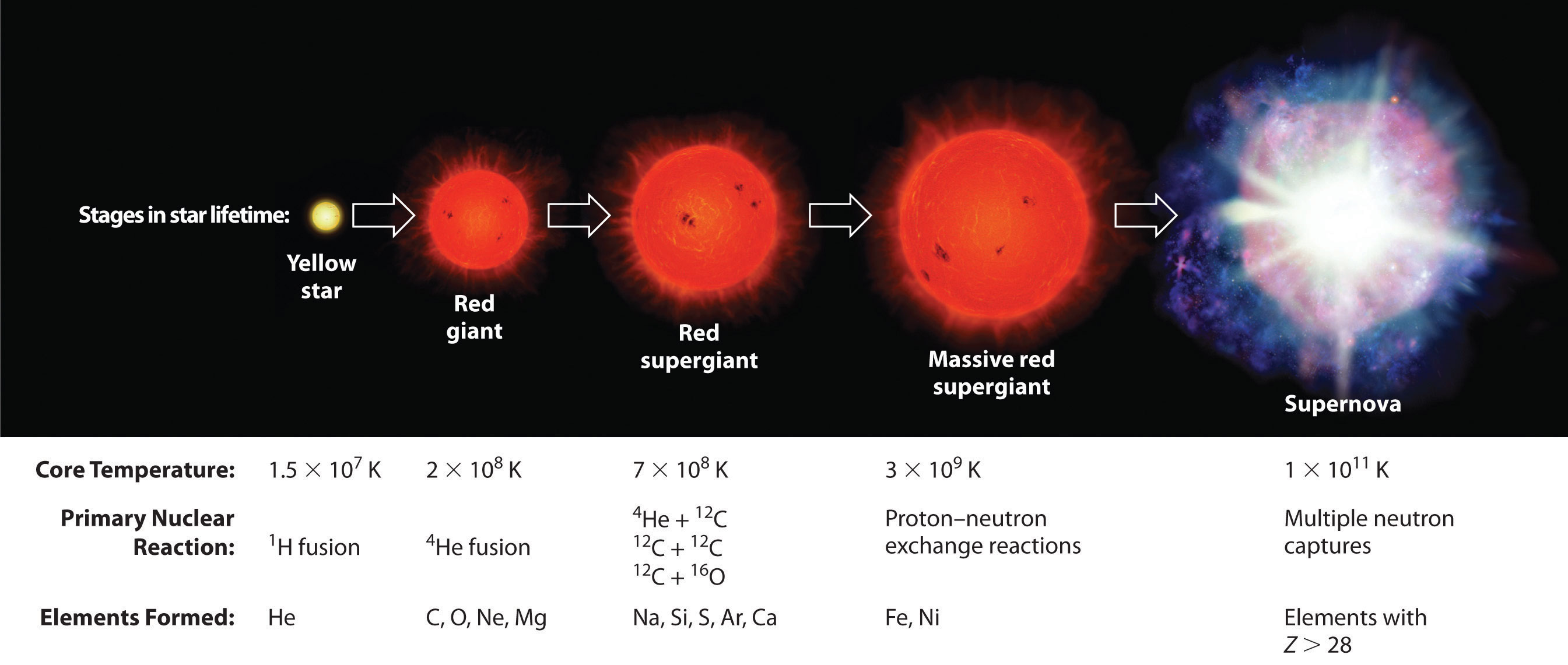
En la primera etapa de su vida, la estrella es impulsada por una serie de reacciones de fusión nuclear que convierten el hidrógeno en helio:
[_ 1 ^ 1 textrm H + , _ 1 ^ 1 textrm H rightarrow , _ 1 ^ 2 textrm H + , _ {+ 1} ^ 0 beta
\ _ 1 ^ 2 textrm H + , _ 1 ^ 1 textrm H rightarrow , _ 2 ^ 3 textrm {He} + , _ {0} ^ 0 gamma
\ _ 2 ^ 3 textrm {He} + , _ 2 ^ 3 textrm {He} rightarrow , _ 2 ^ 4 textrm {He} + 2_ {1} ^ 1 textrm H label {Eq1} ]
La reacción general es la conversión de cuatro núcleos de hidrógeno en un núcleo de helio-4, que se acompaña de la liberación de dos positrones, dos rayos ( gamma ) y una gran cantidad de energía:
[4_1 ^ 1 textrm H rightarrow , _ 2 ^ 4 textrm {He} +2 _ {+ 1} ^ 0 beta + 2_0 ^ 0 gamma label {Eq2} ]
Estas reacciones son responsables de la mayor parte de la enorme cantidad de energía que se libera en forma de luz solar y calor solar. Se necesitan varios miles de millones de años, dependiendo del tamaño de la estrella, para convertir aproximadamente el 10% del hidrógeno en helio.
Una vez que se han formado grandes cantidades de helio-4, se concentran en el núcleo de la estrella, que lentamente se vuelve más densa y más caliente. A una temperatura de aproximadamente 2 × 10 8 K, los núcleos de helio-4 comienzan a fusionarse, produciendo berilio-8:
[2_2 ^ 4 textrm {He} rightarrow , _ 4 ^ 8 textrm {Be} label {Eq3} ]
Aunque el berilio-8 tiene tanto un número de masa par como un número atómico par, también tiene una relación baja de neutrones a protones (y otros factores más allá del alcance de este texto) que lo hace inestable; se descompone en solo 10 −16 s. Sin embargo, esto es lo suficientemente largo como para reaccionar con un tercer núcleo de helio-4 para formar carbono-12, que es muy estable. Las reacciones secuenciales de carbono-12 con helio-4 producen los elementos con números pares de protones y neutrones hasta magnesio-24:
[_ 4 ^ 8 textrm {Be} xrightarrow {_2 ^ 4 textrm {He}} , _ 6 ^ {12} textrm C xrightarrow {_2 ^ 4 textrm {He}} , _ 8 ^ {16} textrm O xrightarrow {_2 ^ 4 textrm {He}} , _ {10} ^ {20} textrm {Ne} xrightarrow {_2 ^ 4 textrm {He}} , _ { 12} ^ {24} textrm {Mg} label {Eq4} ]
Estas reacciones liberan tanta energía que hace que la masa de hidrógeno circundante se expanda, produciendo un gigante rojo que es aproximadamente 100 veces más grande que la estrella amarilla original.
A medida que la estrella se expande, los núcleos más pesados se acumulan en su núcleo, que se contrae aún más a una densidad de aproximadamente 50,000 g / cm3, por lo que el núcleo se vuelve aún más caliente. A una temperatura de aproximadamente 7 × 10 8 K, los núcleos de carbono y oxígeno experimentan reacciones de fusión nuclear para producir núcleos de sodio y silicio:
[_ 6 ^ {12} textrm C + , _ 6 ^ {12} textrm C rightarrow , _ {11} ^ {23} textrm {Na} + , _ 1 ^ 1 textrm H etiqueta {Eq5} ]
[_ 6 ^ {12} textrm C + , _ 8 ^ {16} textrm O rightarrow , _ {14} ^ {28} textrm {Si} + , _ 0 ^ 0 gamma label {Eq6} ]
A estas temperaturas, el carbono-12 reacciona con el helio-4 para iniciar una serie de reacciones que producen más oxígeno-16, neón-20, magnesio-24 y silicio-28, así como nucleidos más pesados como el azufre- 32, argón-36 y calcio-40:
[_ 6 ^ {12} textrm C xrightarrow {_2 ^ 4 textrm {He}} , _ 8 ^ {16} textrm O xrightarrow {_2 ^ 4 textrm {He}} , _ {10} ^ {20} textrm {Ne} xrightarrow {_2 ^ 4 textrm {He}} , _ {12} ^ {24} textrm {Mg} xrightarrow {_2 ^ 4 textrm {He} } , _ {14} ^ {28} textrm {Si} xrightarrow {_2 ^ 4 textrm {He}} , _ {16} ^ {32} textrm S xrightarrow {_2 ^ 4 textrm { Él}} , _ {18} ^ {36} textrm {Ar} xrightarrow {_2 ^ 4 textrm {He}} , _ {20} ^ {40} textrm {Ca} label {Eq7} ]
La energía liberada por estas reacciones provoca una mayor expansión de la estrella para formar una supergigante roja, y la temperatura central aumenta de manera constante. A una temperatura de aproximadamente 3 × 10 9 K, los núcleos que se han formado intercambian libremente protones y neutrones. Este proceso de equilibrio forma elementos más pesados hasta el hierro-56 y el níquel-58, que tienen los núcleos más estables conocidos.
La formación de elementos más pesados en supernovas
Ninguno de los procesos descritos hasta ahora produce núcleos con Z> 28. Todos los elementos naturales más pesados que el níquel se forman en las explosiones cataclísmicas raras pero espectaculares llamadas supernovas ( Figura ( PageIndex {2} ) ). Cuando el combustible en el núcleo de una estrella muy masiva se ha consumido, su gravedad hace que se colapse en aproximadamente 1 s. A medida que el núcleo se comprime, los núcleos de hierro y níquel se desintegran en protones y neutrones, y muchos de los protones capturan electrones para formar neutrones. La estrella de neutrones resultante es un objeto oscuro que es tan denso que los átomos ya no existen. Simultáneamente, la energía liberada por el colapso del núcleo hace que la supernova explote en lo que posiblemente sea el evento más violento del universo. La fuerza de la explosión sopla la mayor parte de la materia de la estrella al espacio, creando una nube de polvo o nebulosa gigantesca y de rápida expansión ( Figura ( PageIndex {3} ) ). Durante la extraordinariamente corta duración de este evento, la concentración de neutrones es tan grande que ocurren múltiples eventos de captura de neutrones, lo que lleva a la producción de los elementos más pesados y muchos de los nucleidos menos estables. En estas condiciones, por ejemplo, un núcleo de hierro-56 puede absorber hasta 64 neutrones, formando brevemente un isótopo de hierro extraordinariamente inestable que luego puede sufrir múltiples procesos rápidos de descomposición β para producir estaño-120:
[_ {26} ^ {56} textrm {Fe} + 64_0 ^ 1 textrm n rightarrow , _ {26} ^ {120} textrm {Fe} rightarrow , _ {50} ^ {120} textrm {Sn} +24 _ {- 1} ^ 0 beta label {Eq8} ]
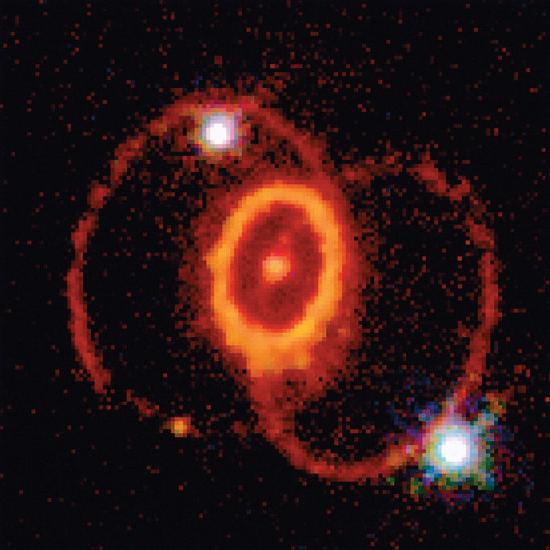
Aunque una supernova ocurre solo cada pocos cientos de años en una galaxia como la Vía Láctea, estas explosiones raras proporcionan las únicas condiciones bajo las cuales se pueden formar elementos más pesados que el níquel. La fuerza de las explosiones distribuye estos elementos en toda la galaxia que rodea a la supernova, y finalmente son capturados en el polvo que se condensa para formar nuevas estrellas. Según su composición elemental, se cree que nuestro sol es una estrella de segunda o tercera generación. Contiene una cantidad considerable de desechos cósmicos de la explosión de supernovas en el pasado remoto.
Resumen
El hidrógeno y el helio son los elementos más abundantes en el universo. Los elementos más pesados se forman en el interior de las estrellas a través de múltiples eventos de captura de neutrones. Con mucho, el elemento más abundante en el universo es el hidrógeno. La fusión de los núcleos de hidrógeno para formar núcleos de helio es el proceso principal que alimenta estrellas jóvenes como el sol. Los elementos más pesados que el helio están formados por hidrógeno y helio en el interior de las estrellas. Las sucesivas reacciones de fusión de los núcleos de helio a temperaturas más altas crean elementos con números pares de protones y neutrones hasta el magnesio y luego hasta el calcio. Finalmente, los elementos hasta el hierro-56 y el níquel-58 se forman mediante procesos de intercambio a temperaturas aún más altas. Los elementos más pesados solo se pueden hacer mediante un proceso que involucra múltiples eventos de captura de neutrones, que solo pueden ocurrir durante la explosión de una supernova.