La ecuación de Nernst permite la determinación del potencial celular en condiciones no estándar. Relaciona el potencial celular medido con el cociente de reacción y permite la determinación precisa de las constantes de equilibrio (incluidas las constantes de solubilidad).
El efecto de la concentración en el potencial celular: la ecuación de Nernst
Recuerde que el cambio real de energía libre para una reacción en condiciones no estándar, ( Delta {G} ), se da de la siguiente manera:
[ Delta {G} = Delta {G °} + RT ln Q label {Eq1} ]
También sabemos que (ΔG = −nFE_ {cell} ) (bajo conficiones no estándar) y (ΔG ^ o = −nFE ^ o_ {cell} ) (bajo condiciones estándar). Sustituyendo estas expresiones en la ecuación ( ref {Eq1} ), obtenemos
[- nFE_ {cell} = −nFE ^ o_ {cell} + RT ln Q label {Eq2} ]
Dividiendo ambos lados de esta ecuación por (- nF ),
[E_ textrm {cell} = E ^ circ_ textrm {cell} – left ( dfrac {RT} {nF} right) ln Q label {Eq3} ]
La ecuación ( ref {Eq3} ) se llama ecuación de Nernst , en honor al físico y químico alemán Walter Nernst (1864–1941), quien la derivó por primera vez. La ecuación de Nernst es posiblemente la relación más importante en electroquímica. Cuando una reacción redox está en equilibrio ( (ΔG = 0 )), la ecuación ( ref {Eq3} ) se reduce a la ecuación ( ref {Eq31} ) y ( ref {Eq32} ) porque (Q = K ), y no hay transferencia neta de electrones (es decir, E celda = 0).
[E_ textrm {cell} = E ^ circ_ textrm {cell} – left ( dfrac {RT} {nF} right) ln K = 0 label {Eq31} ] [19459014 ]
desde
[E ^ circ_ textrm {cell} = left ( dfrac {RT} {nF} right) ln K label {Eq32} ]
Sustituyendo los valores de las constantes en la ecuación ( ref {Eq3} ) con (T = 298 , K ) y convirtiendo a logaritmos en base 10 da la relación del potencial celular real (E celda ), el potencial celular estándar (E ° celda ), y las concentraciones de reactivo y producto a temperatura ambiente (contenido en (Q )):
[E _ { textrm {cell}} = E ^ circ_ textrm {cell} – left ( dfrac { textrm {0.0591 V}} {n} right) log Q label {Eq4 } ]
La ecuación ( ref {Eq4} ) nos permite calcular el potencial asociado con cualquier celda electroquímica a 298 K para cualquier combinación de reactivo y concentraciones de producto bajo cualquier condición. Por lo tanto, podemos determinar la dirección espontánea de cualquier reacción redox en cualquier condición, siempre que tengamos valores tabulados para los potenciales de electrodo estándar relevantes. Observe en la ecuación ( ref {Eq4} ) que el potencial de la celda cambia en 0.0591 / n V por cada cambio de 10 veces en el valor de (Q ) porque log 10 = 1.
La aplicación de la ecuación de Nernst a una celda electroquímica simple como la celda Zn / Cu nos permite ver cómo varía el voltaje de la celda a medida que progresa la reacción y cambian las concentraciones de los iones disueltos. Recuerde que la reacción general para esta célula es la siguiente:
[Zn (s) + Cu ^ {2 +} (aq) rightarrow Zn ^ {2 +} (aq) + Cu (s) ; ; ; E ° celda = 1.10 V etiqueta { Eq5} ]
El cociente de reacción es por lo tanto (Q = [Zn ^ {2 +}] / [Cu ^ {2 +}] ). Suponga que la celda contiene inicialmente 1.0 M Cu 2 + y 1.0 × 10 −6 M Zn 2 + [19459030 ] El voltaje inicial medido cuando la celda está conectada puede calcularse a partir de la ecuación ( ref {Eq4} ):
[ begin {align} E_ textrm {cell} & = E ^ circ_ textrm {cell} – left ( dfrac { textrm {0.0591 V}} {n} right) log dfrac {[ mathrm {Zn ^ {2 +}}]} {[ mathrm {Cu ^ {2 +}}]} \
& = textrm {1.10 V} – left ( dfrac { textrm {0.0591 V}} {2} right) log left ( dfrac {1.0 times10 ^ {- 6}} {1.0} right) = textrm {1.28 V} end {align} label { Eq6} ]
Por lo tanto, el voltaje inicial es mayor que E ° porque (Q <1 ). A medida que avanza la reacción, [Zn 2 + ] en el compartimento del ánodo aumenta a medida que el electrodo de zinc se disuelve, mientras que [Cu 2 + ] en el compartimiento del cátodo disminuye a medida que se deposita cobre metálico sobre el electrodo. Durante este proceso, la relación Q = [Zn 2 + ] / [Cu 2 + ] aumenta constantemente, y el voltaje de la celda aumenta constantemente. por lo tanto disminuye constantemente. Eventualmente, [Zn 2 + ] = [Cu 2 + ], entonces Q = 1 y E celda [19459022 ] = E ° celda . Más allá de este punto, [Zn 2 + ] continuará aumentando en el compartimiento del ánodo, y [Cu 2 + ] continuará para disminuir en el compartimiento del cátodo. Por lo tanto, el valor de Q aumentará aún más, lo que conducirá a una disminución adicional en la celda E . Cuando las concentraciones en los dos compartimentos son opuestas a las concentraciones iniciales (es decir, 1.0 M Zn 2 + y 1.0 × 10 −6 M Cu [19459029 ] 2 + ), Q = 1.0 × 10 6 , y el potencial celular se reducirá a 0.92 V.

La variación de la celda E con ( log {Q} ) sobre este rango es lineal con una pendiente de −0.0591 / n, como se ilustra en la Figura ( PageIndex {1} ) A medida que la reacción continúa aún más, (Q ) continúa aumentando, y la celda E continúa disminuyendo. Si ninguno de los electrodos se disuelve por completo, rompiendo así el circuito eléctrico, el voltaje de la celda finalmente llegará a cero. Esta es la situación que ocurre cuando una batería está “agotada”. El valor de (Q ) cuando la celda E = 0 se calcula de la siguiente manera:
[ begin {align} E_ textrm {cell} & = E ^ circ_ textrm {cell} – left ( dfrac { textrm {0.0591 V}} {n} right) log Q = 0 \
E ^ circ & = left ( dfrac { textrm {0.0591 V}} {n} right) log Q \
log Q & = dfrac {E ^ circ n} { textrm {0.0591 V}} = dfrac {( textrm {1.10 V}) (2)} { textrm {0.0591 V}} = 37.23 \
Q & = 10 ^ {37.23 } = 1.7 times10 ^ {37} end {align} label {Eq7} ]
Recordemos que en equilibrio, (Q = K ). Por lo tanto, la constante de equilibrio para la reacción del metal Zn con Cu 2 + para dar Cu metal y Zn 2 + es 1.7 × 10 37 a 25 ° C.
Células de concentración
También se puede generar un voltaje construyendo una celda electroquímica en la que cada compartimento contiene la misma solución activa redox pero a diferentes concentraciones. El voltaje se produce a medida que las concentraciones se equilibran. Supongamos, por ejemplo, que tenemos una celda con 0.010 M AgNO 3 en un compartimento y 1.0 M AgNO 3 en el otro. El diagrama celular y las semirreacciones correspondientes son las siguientes:
[ ce {Ag (s) , | , Ag ^ {+}} (aq, 0.010 ; M) , || , ce {Ag ^ {+}} (aq, 1.0 ; M) , | , ce {Ag (s)} label {Eq8} ]
cátodo:
[ ce {Ag ^ {+}} (aq, 1.0 ; M) + ce {e ^ {-}} rightarrow ce {Ag (s)} label {Eq9} ] [ 19459014]
ánodo:
[ ce {Ag (s)} rightarrow ce {Ag ^ {+}} (aq, 0.010 ; M) + ce {e ^ {-}} label {Eq10} ] [ 19459014]
En general
[ ce {Ag ^ {+}} (aq, 1.0 ; M) rightarrow ce {Ag ^ {+}} (aq, 0.010 ; M) label {Eq11} ] [19459014 ]
A medida que avanza la reacción, la concentración de (Ag ^ + ) aumentará en el compartimento izquierdo (oxidación) a medida que se disuelve el electrodo de plata, mientras que la concentración (Ag ^ + ) en el compartimento derecho (reducción) disminuye a medida que el electrodo en ese compartimento gana masa. Sin embargo, la masa total de (Ag (s) ) en la celda permanecerá constante. Podemos calcular el potencial de la celda usando la ecuación de Nernst, insertando 0 para la celda E ° porque E ° cátodo = −E ° ánodo :
[ begin {align *} E_ textrm {cell} & = E ^ circ_ textrm {cell} – left ( dfrac { textrm {0.0591 V}} {n} right) log Q \ [4pt] & = 0- left ( dfrac { textrm {0.0591 V}} {1} right) log left ( dfrac {0.010} {1.0} right) \ [4pt] & = textrm {0.12 V} end {align *} ]
Una celda electroquímica de este tipo, en la cual los compartimentos anódico y catódico son idénticos, excepto por la concentración de un reactivo, se llama celda de concentración . A medida que avanza la reacción, la diferencia entre las concentraciones de Ag + en los dos compartimentos disminuirá, al igual que la célula E . Finalmente, cuando la concentración de Ag + es la misma en ambos compartimentos, se habrá alcanzado el equilibrio y la diferencia de potencial medida entre los dos compartimentos será cero (E celda = 0 )
Uso de potenciales celulares para medir productos de solubilidad
Debido a que los voltajes son relativamente fáciles de medir con precisión utilizando un voltímetro, los métodos electroquímicos proporcionan una forma conveniente de determinar las concentraciones de soluciones muy diluidas y los productos de solubilidad ( (K_ {sp} )) de sustancias escasamente solubles. Como aprendió anteriormente, los productos de solubilidad pueden ser muy pequeños, con valores inferiores o iguales a 10 −30 . Las constantes de equilibrio de esta magnitud son prácticamente imposibles de medir con precisión por métodos directos, por lo que debemos utilizar métodos alternativos que sean más sensibles, como los métodos electroquímicos.
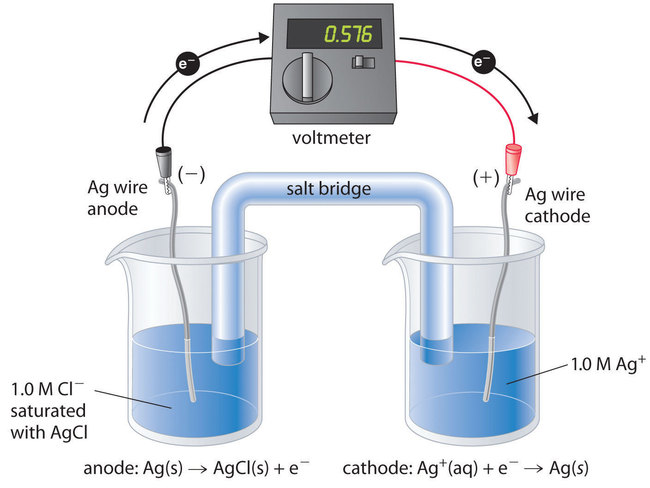
Para comprender cómo se usa una celda electroquímica para medir un producto de solubilidad, considere la celda que se muestra en la Figura ( PageIndex {1} ), que está diseñada para medir el producto de solubilidad del cloruro de plata:
[K_ {sp} = [ ce {Ag ^ {+}}] [ ce {Cl ^ {-}}]. nonumber ]
En un compartimento, la celda contiene un alambre de plata insertado en una solución de Ag 1,0 M + ; el otro compartimento contiene un alambre de plata insertado en una solución de Cl [1.0454529] – saturada con AgCl. En este sistema, la concentración de iones Ag + en el primer compartimento es igual a K sp . Podemos ver esto dividiendo ambos lados de la ecuación para K sp por [Cl – ] y sustituyendo:
[ begin {align *} [ ce {Ag ^ {+}}] & = dfrac {K_ {sp}} {[ ce {Cl ^ {-}}]} \ [4pt] & = Dfrac {K_ {sp}} {1.0} = K_ {sp}. end {align *} ]
La reacción celular global es la siguiente:
Ag + (acuoso, concentrado) → Ag + (acuoso, diluido)
Por lo tanto, el voltaje de la celda de concentración debido a la diferencia en [Ag + ] entre las dos celdas es el siguiente:
[ begin {align} E_ textrm {cell} & = textrm {0 V} – left ( dfrac { textrm {0.0591 V}} {1} right) log left ( dfrac {[ mathrm {Ag ^ +}] _ textrm {dilute}} {[ mathrm {Ag ^ +}] _ textrm {concentrado}} right) nonumber \ [4pt] & = – textrm {0.0591 V} log left ( dfrac {K _ { textrm {sp}}} {1.0} right) nonumber \ [4pt] & = – textrm {0.0591 V} log K _ { textrm { sp}} label {Eq122} end {align} ]
Al cerrar el circuito, podemos medir el potencial causado por la diferencia en [Ag +] en las dos celdas. En este caso, el voltaje medido experimentalmente de la celda de concentración a 25 ° C es 0.580 V. Resolver la ecuación ( ref {Eq122} ) para (K_ {sp} ),
[ begin {align *} log K_ textrm {sp} & = dfrac {-E_ textrm {cell}} { textrm {0.0591 V}} = dfrac {- textrm {0.580 V }} { textrm {0.0591 V}} = – 9.81 \ [4pt]
K_ textrm {sp} & = 1.5 times10 ^ {- 10} end {align *} ]
Por lo tanto, una sola medición de potencial puede proporcionar la información que necesitamos para determinar el valor del producto de solubilidad de una sal escasamente soluble.
Uso de potenciales celulares para medir concentraciones
Otro uso para la ecuación de Nernst es calcular la concentración de una especie dado un potencial medido y las concentraciones de todas las otras especies. Vimos un ejemplo de esto en el Ejemplo ( PageIndex {3} ), en el que las condiciones experimentales se definieron de tal manera que la concentración del ion metálico era igual a K sp . Las mediciones potenciales también se pueden utilizar para obtener las concentraciones de especies disueltas en otras condiciones, lo que explica el uso generalizado de las células electroquímicas en muchos dispositivos analíticos. Quizás la aplicación más común es la determinación de [H + ] usando un medidor de pH, como se ilustra a continuación.
Resumen
La ecuación de Nernst se puede usar para determinar la dirección de la reacción espontánea para cualquier reacción redox en solución acuosa. La ecuación de Nernst nos permite determinar la dirección espontánea de cualquier reacción redox en cualquier condición de reacción a partir de los valores de los potenciales de electrodo estándar relevantes. Las células de concentración consisten en compartimientos anódicos y catódicos que son idénticos, excepto por las concentraciones del reactivo. Debido a que ΔG = 0 en equilibrio, el potencial medido de una celda de concentración es cero en equilibrio (las concentraciones son iguales). Una celda galvánica también puede usarse para medir el producto de solubilidad de una sustancia escasamente soluble y calcular la concentración de una especie dado un potencial medido y las concentraciones de todas las otras especies.