En una celda galvánica, la corriente se produce cuando los electrones fluyen externamente a través del circuito desde el ánodo al cátodo debido a una diferencia en la energía potencial entre los dos electrodos en la celda electroquímica. En el sistema Zn / Cu, los electrones de valencia en zinc tienen una energía potencial sustancialmente mayor que los electrones de valencia en cobre debido a la protección de los electrones de zinc por los electrones en los orbitales llenos. Por lo tanto, los electrones fluyen espontáneamente de los iones de zinc a cobre (II), formando iones de zinc (II) y cobre metálico. Al igual que el agua que fluye espontáneamente cuesta abajo, que se puede hacer que funcione al forzar una rueda hidráulica, el flujo de electrones de una energía potencial más alta a una más baja también se puede aprovechar para realizar el trabajo.
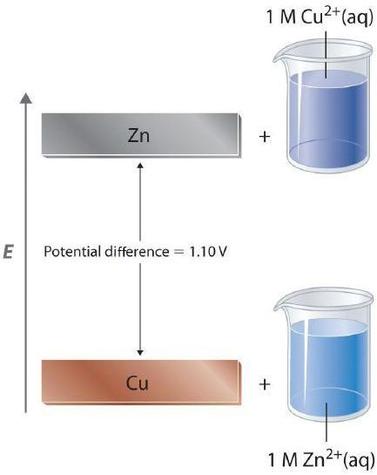
Debido a que la energía potencial de los electrones de valencia difiere mucho de una sustancia a otra, el voltaje de una celda galvánica depende en parte de la identidad de las sustancias que reaccionan. Si construimos una celda galvánica similar a la de la parte (a) en la Figura ( PageIndex {1} ) pero en lugar de cobre, use una tira de metal cobalto y 1 M Co 2 + en el compartimiento del cátodo, el voltaje medido no es 1.10 V sino 0.51 V. Por lo tanto, podemos concluir que la diferencia en energía potencial entre los electrones de valencia de cobalto y zinc es menor que la diferencia entre los electrones de valencia de cobre y zinc por 0.59 V.
El potencial medido de una célula también depende en gran medida de las concentraciones de las especies que reaccionan y de la temperatura del sistema. Para desarrollar una escala de potenciales relativos que nos permita predecir la dirección de una reacción electroquímica y la magnitud de la fuerza impulsora de la reacción, los potenciales de oxidación y reducción de diferentes sustancias deben medirse en condiciones comparables. Para hacer esto, los químicos usan el potencial celular estándar (E ° celda ), definido como el potencial de una celda medida en condiciones estándar, es decir, con todas las especies en sus estados estándar (1 M para soluciones, las soluciones concentradas de sales (aproximadamente 1 M) generalmente no exhiben un comportamiento ideal, y el estado estándar real corresponde a una actividad de 1 en lugar de una concentración de 1 M. Las correcciones para el comportamiento no ideal son importantes para precisar trabajo cuantitativo, pero no para el enfoque más cualitativo que estamos adoptando aquí (1 atm para gases, sólidos puros o líquidos puros para otras sustancias) y a una temperatura fija, generalmente 25 ° C.
Los potenciales redox medidos dependen de la energía potencial de los electrones de valencia, las concentraciones de las especies en la reacción y la temperatura del sistema.
Medición de potenciales de electrodos estándar
Es físicamente imposible medir el potencial de un solo electrodo: solo se puede medir la diferencia entre los potenciales de dos electrodos (esto es análogo a medir entalpías absolutas o energías libres [19459021 ]; recuerde que solo se pueden medir las diferencias en entalpía y energía libre.) Sin embargo, podemos comparar los potenciales de celda estándar para dos celdas galvánicas diferentes que tienen un tipo de electrodo en común. Esto nos permite medir la diferencia de potencial entre dos electrodos diferentes. Por ejemplo, el potencial de celda estándar medido (E °) para el sistema Zn / Cu es 1.10 V, mientras que E ° para el sistema Zn / Co correspondiente es 0.51 V. Esto implica que la diferencia de potencial entre los electrodos Co y Cu es 1.10 V – 0,51 V = 0,59 V. De hecho, ese es exactamente el potencial medido en condiciones estándar si una celda se construye con el siguiente diagrama de celda:
[Co _ {(s)} ∣ Co ^ {2 +} (aq, 1 M) ∥Cu ^ {2 +} (aq, 1 M) ∣ Cu (s) ; ; ; E ° = 0.59 ; V label {20.4.1} ]
Este diagrama de celda corresponde a la oxidación de un ánodo de cobalto y la reducción de Cu 2 + en solución en el cátodo de cobre.
Todos los valores tabulados de los potenciales de electrodo estándar por convención se enumeran para una reacción escrita como una reducción, no como una oxidación, para poder comparar los potenciales estándar para diferentes sustancias ( Tabla P1 ). El potencial celular estándar (E ° celda ) es, por lo tanto, la diferencia entre los potenciales de reducción tabulados de las dos medias reacciones, no su suma:
[E ° _ {celda} = E ° _ {cátodo} – E ° _ {ánodo} etiqueta {20.4.2} ]
En contraste, recuerde que las medias reacciones se escriben para mostrar las reacciones de reducción y oxidación que realmente ocurren en la célula, por lo que la reacción celular general se escribe como la suma de las dos medias reacciones. De acuerdo con la Ecuación ( ref {20.4.2} ), cuando conocemos el potencial estándar para cualquier semirreacción, podemos obtener el valor del potencial estándar de muchas otras semirreacciones midiendo el potencial estándar de celda correspondiente.
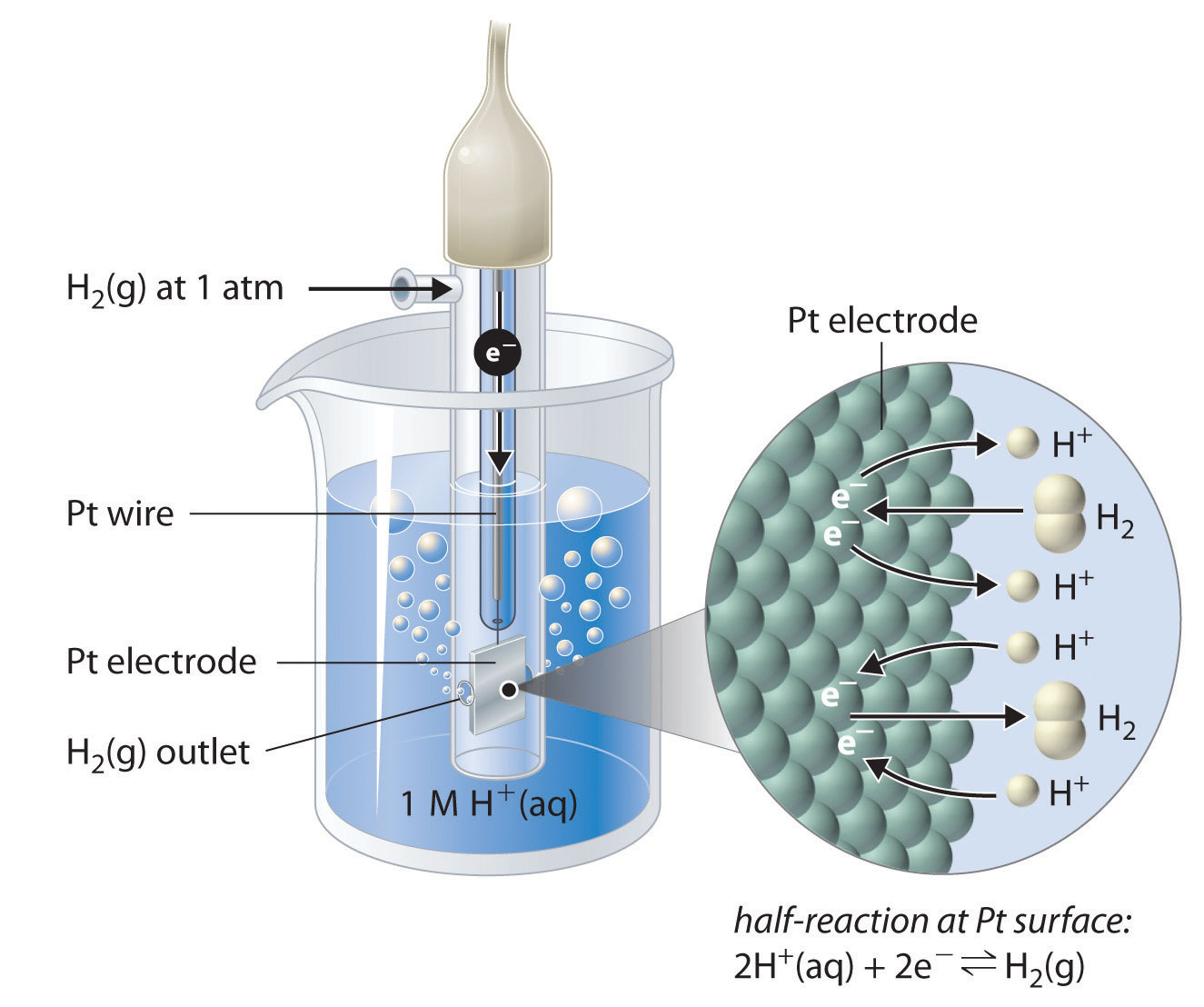
Aunque es imposible medir el potencial de cualquier electrodo directamente, podemos elegir un electrodo de referencia cuyo potencial se defina como 0 V en condiciones estándar. El electrodo de hidrógeno estándar (SHE) se usa universalmente para este propósito y se le asigna un potencial estándar de 0 V. Consiste en una tira de alambre de platino en contacto con una solución acuosa que contiene 1 MH + . El [H + ] en solución está en equilibrio con el gas H 2 a una presión de 1 atm en la interfaz Pt-solución (Figura ( PageIndex {2} )) . Los protones se reducen o las moléculas de hidrógeno se oxidan en la superficie de Pt de acuerdo con la siguiente ecuación:
[2H ^ + _ {(aq)} + 2e ^ – rightleftharpoons H_ {2 (g)} label {20.4.3} ]
Una característica especialmente atractiva del SHE es que el electrodo metálico Pt no se consume durante la reacción.

La figura ( PageIndex {3} ) muestra una celda galvánica que consiste en un SHE en un vaso de precipitados y una tira de Zn en otro vaso de precipitados que contiene una solución de Zn 2 + [19459015 ] iones. Cuando el circuito está cerrado, el voltímetro indica un potencial de 0,76 V. El electrodo de zinc comienza a disolverse para formar Zn 2 + y H + los iones son reducido a H 2 en el otro compartimento. Así, el electrodo de hidrógeno es el cátodo, y el electrodo de zinc es el ánodo. El diagrama para esta celda galvánica es el siguiente:
[Zn _ {(s)} ∣Zn ^ {2 +} _ {(aq)} ∥H ^ + (aq, 1 M) ∣H_2 (g, 1 atm) ∣Pt _ {(s)} etiqueta {20.4.4} ]
Las medias reacciones que realmente ocurren en la célula y sus potenciales de electrodo correspondientes son las siguientes:
- cátodo: [2H ^ + _ {(aq)} + 2e ^ – rightarrow H_ {2 (g)} ; ; ; E ° _ {cátodo} = 0 V etiqueta {20.4.5} ]
- ánodo: [Zn _ {(s)} rightarrow Zn ^ {2 +} _ {(aq)} + 2e ^ – ; ; ; E ° _ {ánodo} = – 0.76 ; V label {20.4.6} ]
- en general: [Zn _ {(s)} + 2H ^ + _ {(aq)} rightarrow Zn ^ {2 +} _ {(aq)} + H_ {2 (g)} label {20.4. 7} ]
[E ° _ {celda} = E ° _ {cátodo} −E ° _ {ánodo} = 0,76 ; V ]
Aunque la reacción en el ánodo es una oxidación, por convención su valor de E ° tabulado se informa como un potencial de reducción. El potencial de una media reacción medido contra el SHE en condiciones estándar se denomina potencial de electrodo estándar para esa media reacción. En este ejemplo, el potencial de reducción estándar para Zn 2 [ 19459014] + (aq) + 2e – → Zn (s) es −0.76 V, lo que significa que el potencial de electrodo estándar para la reacción que ocurre en el ánodo, la oxidación de Zn a Zn 2+ , a menudo llamado Zn / Zn 2 + pareja redox, o Zn / Zn 2 + ] pareja, es – (- 0.76 V) = 0.76 V. Por lo tanto, debemos restar E ° ánodo de E ° cátodo para obtener
[E ° _ {celda}: 0 , V – (−0.76 , V) = 0.76 , V ]
Debido a que el potencial eléctrico es la energía necesaria para mover una partícula cargada en un campo eléctrico, los potenciales de electrodo estándar para las medias reacciones son propiedades intensivas y no dependen de la cantidad de sustancia involucrada. En consecuencia, los valores de E ° son independientes de los coeficientes estequiométricos para la semirreacción y, lo más importante, los coeficientes utilizados para producir una reacción global equilibrada no afectan el valor del potencial celular.
Los valores de E ° NO dependen de los coeficientes estequiométricos para una media reacción, porque es una propiedad intensiva.
Potenciales de electrodo estándar
Para medir el potencial de la pareja Cu / Cu 2 + , podemos construir una célula galvánica análoga a la que se muestra en la Figura ( PageIndex {3} ) pero que contiene una pareja Cu / Cu 2 + en el compartimento de la muestra en lugar de Zn / Zn 2 + . Cuando cerramos el circuito esta vez, el potencial medido para la celda es negativo (−0.34 V) en lugar de positivo. El valor negativo de (E ° _ {cell} ) indica que la dirección del flujo espontáneo de electrones es opuesta a la de la pareja Zn / Zn 2 + . Por lo tanto, las reacciones que ocurren espontáneamente, indicadas por un positivo (E ° _ {cell} ), son la reducción de Cu 2 + a Cu en el electrodo de cobre. El electrodo de cobre gana masa a medida que avanza la reacción, y H 2 se oxida a H + en el electrodo de platino. En esta celda, la tira de cobre es el cátodo, y el electrodo de hidrógeno es el ánodo. Por lo tanto, el diagrama de celda se escribe con el SHE a la izquierda y el Cu 2 + / Cu pareja a la derecha:
[Pt _ {(s)} ∣H_2 (g, 1 atm) ∣H ^ + (aq, 1 ; M) ∥Cu ^ {2 +} (aq, 1 M) ∣Cu _ {(s) } label {20.4.8} ]
Las reacciones de media célula y los potenciales de la reacción espontánea son los siguientes:
- Cátodo: [Cu ^ {2 +} {(aq)} + 2e ^ – rightarrow Cu _ {(g)} ; ; ; E ° _ {cátodo} = 0.34 ; V label {20.4.9} ]
- Ánodo: [H_ {2 (g)} rightarrow 2H ^ + _ {(aq)} + 2e ^ – ; ; ; E ° _ {ánodo} = 0 ; V label {20.4.10} ]
- Total: [H_ {2 (g)} + Cu ^ {2 +} _ {(aq)} rightarrow 2H ^ + _ {(aq)} + Cu _ {(s)} label {20.4. 11} ]
[E ° _ {celda} = E ° _ {cátodo} – E ° _ {ánodo} = 0.34 ; V ]
Por lo tanto, el potencial de electrodo estándar para el Cu 2 + / Cu pareja es 0,34 V.
Balanceando las reacciones redox usando el método de media reacción
En Sección 4.4 , describimos un método para equilibrar las reacciones redox utilizando números de oxidación. Se asignaron números de oxidación a cada átomo en una reacción redox para identificar cualquier cambio en los estados de oxidación. Aquí presentamos un enfoque alternativo para equilibrar las reacciones redox, el método de media reacción, en el que la reacción redox global se divide en una reacción de oxidación y una reacción de reducción, cada una equilibrada por masa y carga. Este método refleja más de cerca los eventos que tienen lugar en una celda electroquímica, donde las dos medias reacciones pueden estar físicamente separadas entre sí.
Podemos ilustrar cómo equilibrar una reacción redox utilizando semirreacciones con la reacción que ocurre cuando Drano, un limpiador comercial de drenaje sólido, se vierte en un drenaje obstruido. Drano contiene una mezcla de hidróxido de sodio y aluminio en polvo, que en solución reacciona para producir hidrógeno gaseoso:
[Al _ {(s)} + OH ^ −_ {(aq)} rightarrow Al (OH) ^ −_ {4 (aq)} + H_ {2 (g)} label {20.4.12 } ]
En esta reacción, (Al _ {(s)} ) se oxida a Al 3 + , y H + en agua se reduce a H 2 gas, que burbujea a través de la solución, agitándolo y rompiendo las obstrucciones.
La reacción redox global se compone de una semirreacción de reducción y una semirreacción de oxidación. De los potenciales de electrodo estándar enumerados Tabla P1 , encontramos las correspondientes semirreacciones que describen la reducción de iones H + en agua a H 2 y la oxidación de Al a Al 3 + en solución básica:
- reducción: [2H_2O _ {(l)} + 2e ^ – rightarrow 2OH ^ −_ {(aq)} + H_ {2 (g)} label {20.4.13} ]
- oxidación: [Al _ {(s)} + 4OH ^ −_ {(aq)} rightarrow Al (OH) ^ −_ {4 (aq)} + 3e ^ – label {20.4.14} ]
Las medias reacciones elegidas deben reflejar exactamente las condiciones de reacción, como las condiciones básicas que se muestran aquí. Además, los estados físicos de los reactivos y los productos deben ser idénticos a los dados en la reacción global, ya sea gaseosa, líquida, sólida o en solución.
En la ecuación ( ref {20.4.13} ), dos iones H + ganan un electrón cada uno en la reducción; En la ecuación ( ref {20.4.14} ), el átomo de aluminio pierde tres electrones en la oxidación. Las cargas se equilibran multiplicando la semirreacción de reducción (Ecuación ( ref {20.4.13} )) por 3 y la semirreacción de oxidación (Ecuación ( ref {20.4.14} )) por 2 a dar la misma cantidad de electrones en ambas semirreacciones:
[6H_2O _ {(l)} + 6e ^ – rightarrow 6OH ^ −_ {(aq)} + 3H_ {2 (g)} label {20.4.15} ]
[2Al _ {(s)} + 8OH ^ −_ {(aq)} rightarrow 2Al (OH) ^ −_ {4 (aq)} + 6e ^ – label {20.4.16} ] [ 19459010]
Agregando las dos medias reacciones,
[6H_2O _ {(l)} + 2Al _ {(s)} + 8OH ^ −_ {(aq)} rightarrow 2Al (OH) ^ – {4 (aq)} + 3H_ {2 (g)} + 6OH ^ −_ {(aq)} label {20.4.17} ]
Simplificando cancelando sustancias que aparecen en ambos lados de la ecuación,
[6H_2O _ {(l)} + 2Al _ {(s)} + 2OH ^ −_ {(aq)} rightarrow 2Al (OH) ^ −_ {4 (aq)} + 3H_ {2 (g) } label {20.4.18} ]
Tenemos una carga −2 en el lado izquierdo de la ecuación y una carga −2 en el lado derecho. Por lo tanto, las cargas están equilibradas, pero también debemos verificar que los átomos estén equilibrados:
[2Al + 😯 + 14H = 2Al + 😯 + 14H label {20.4.19} ]
Los átomos también se equilibran, por lo que la ecuación ( ref {20.4.18} ) es una ecuación química equilibrada para la reacción redox representada en la ecuación ( ref {20.4.12} ).
El método de media reacción requiere que las medias reacciones reflejen exactamente las condiciones de reacción, y los estados físicos de los reactivos y los productos deben ser idénticos a los de la reacción general.
También podemos equilibrar una reacción redox equilibrando primero los átomos en cada media reacción y luego equilibrando las cargas. Con este método alternativo, no necesitamos usar las medias reacciones listadas en Tabla P1 , sino centrarnos en los átomos cuyos estados de oxidación cambian, como se ilustra en los siguientes pasos:
Paso 1: Escribe la semirreacción de reducción y la semirreacción de oxidación.
Para la reacción mostrada en la Ecuación ( ref {20.4.12} ), el hidrógeno se reduce de H + en OH – a H 2 [19459023 ], y el aluminio se oxida de Al ° a Al 3 + :
[OH ^ −_ {(aq)} rightarrow H_ {2 (g)} label {20.4.20} ]
[Al _ {(s)} rightarrow Al (OH) ^ −_ {4 (aq)} label {20.4.21} ]
Paso 2: Balancea los átomos balanceando elementos que no sean O y H. Luego balancea los átomos O agregando H 2 O y balancea los átomos H agregando H + .
Los elementos distintos de O y H en las dos ecuaciones anteriores se equilibran tal como están escritos, por lo que procedemos a equilibrar los átomos de O. Podemos hacer esto agregando agua al lado apropiado de cada semirreacción:
[OH ^ −_ {(aq)} rightarrow H_ {2 (g)} + H_2O _ {(l)} label {20.4.22} ]
[Al _ {(s)} + 4H_2O _ {(l)} rightarrow Al (OH) ^ −_ {4 (aq)} label {20.4.23} ]
Equilibrando los átomos de H agregando H + , obtenemos lo siguiente:
[OH ^ −_ {(aq)} + 3H ^ + _ {(aq)} rightarrow H_ {2 (g)} + H_2O _ {(l)} label {20.4.24} ] [ 19459010]
[Al _ {(s)} + 4H_2O _ {(l)} rightarrow Al (OH) ^ −_ {4 (aq)} + 4H ^ + _ {(aq)} label {20.4.25} ]
Ahora hemos equilibrado los átomos en cada media reacción, pero las cargas no están equilibradas.
Paso 3: Balancea las cargas en cada semirreacción agregando electrones.
Se obtienen dos electrones en la reducción de iones H + a H 2 , y se pierden tres electrones durante la oxidación de Al ° a Al 3 + :
[OH ^ −_ {(aq)} + 3H ^ + _ {(aq)} + 2e ^ – rightarrow H_ {2 (g)} + H_2O _ {(l)} label {20.4.26 } ]
[Al _ {(s)} + 4H_2O _ {(l)} rightarrow Al (OH) ^ −_ {4 (aq)} + 4H ^ + _ {(aq)} + 3e ^ – label { 20.4.27} ]
Paso 4: Multiplique las semirreacciones reductiva y oxidativa por enteros apropiados para obtener el mismo número de electrones en ambas semirreacciones.
En este caso, multiplicamos la ecuación ( ref {20.4.26} ) (la semirreacción reductora) por 3 y la ecuación ( ref {20.4.27} ) (la semirreacción oxidativa) por 2 para obtener el mismo número de electrones en ambas semirreacciones:
[3OH ^ −_ {(aq)} + 9H ^ + _ {(aq)} + 6e ^ – rightarrow 3H_ {2 (g)} + 3H_2O _ {(l)} label {20.4.28 } ]
[2Al _ {(s)} + 8H_2O _ {(l)} rightarrow 2Al (OH) ^ −_ {4 (aq)} + 8H ^ + _ {(aq)} + 6e ^ – label { 20.4.29} ]
Paso 5: Agregue las dos medias reacciones y cancele las sustancias que aparecen en ambos lados de la ecuación.
Agregando y, en este caso, cancelando 8H + , 3H 2 O y 6e – ,
[2Al _ {(s)} + 5H_2O _ {(l)} + 3OH ^ −_ {(aq)} + H ^ + _ {(aq)} rightarrow 2Al (OH) ^ −_ {4 ( aq)} + 3H_ {2 (g)} label {20.4.30} ]
Tenemos tres OH – y un H + en el lado izquierdo. Neutralizar el H + nos da un total de 5H 2 O + H 2 O = 6H 2 O y deja 2OH – en el lado izquierdo:
[2Al _ {(s)} + 6H_2O _ {(l)} + 2OH ^ −_ {(aq)} rightarrow 2Al (OH) ^ −_ {4 (aq)} + 3H_ {2 (g) } label {20.4.31} ]
Paso 6: Verifique para asegurarse de que todos los átomos y las cargas estén equilibrados.
La ecuación ( ref {20.4.31} ) es idéntica a la ecuación ( ref {20.4.18} ), obtenida utilizando el primer método, por lo que las cargas y números de átomos en cada lado de la ecuación equilibrar.
Cálculo de los potenciales de celda estándar
El potencial celular estándar para una reacción redox (célula E ° ) es una medida de la tendencia de los reactivos en sus estados estándar a formar productos en sus estados estándar; en consecuencia, es una medida de la fuerza impulsora de la reacción, que anteriormente llamamos voltaje. Podemos usar los dos potenciales de electrodo estándar que encontramos anteriormente para calcular el potencial estándar para la celda Zn / Cu representada por el siguiente diagrama de celda:
[Zn {(s)} ∣Zn ^ {2 +} (aq, 1 M) ∥Cu ^ {2 +} (aq, 1 M) ∣Cu _ {(s)} label {20.4.32 } ]
Conocemos los valores de E ° ánodo para la reducción de Zn 2 + y E ° cátodo para la reducción de Cu 2 + , para que podamos calcular (E ° _ {cell} ):
- cátodo: [Cu ^ {2 +} _ {(aq)} + 2e ^ – rightarrow Cu _ {(s)} ; ; ; E ° _ {cátodo} = 0.34 ; V label {20.4.33} ]
- ánodo: [Zn _ {(s)} rightarrow Zn ^ {2 +} (aq, 1 M) + 2e ^ – ; ; ; E ° _ {ánodo} = −0.76 ; V label {20.4.34} ]
- en general: [Zn _ {(s)} + Cu ^ {2 +} _ {(aq)} rightarrow Zn ^ {2 +} _ {(aq)} + Cu _ {(s)} label { 20.4.35} ]
[E ° _ {celda} = E ° _ {cátodo} – E ° _ {ánodo} = 1.10 ; V ]
Este es el mismo valor que se observa experimentalmente. Si el valor de (E ° _ {cell} ) es positivo, la reacción ocurrirá espontáneamente como está escrito. Si el valor de (E ° _ {cell} ) es negativo, entonces la reacción no es espontánea y no ocurrirá como está escrito en condiciones estándar; sin embargo, procederá espontáneamente en la dirección opuesta. Como veremos en Sección 20.9 , esto no significa que no se pueda hacer que la reacción ocurra bajo condiciones estándar. Con un aporte suficiente de energía eléctrica, se puede forzar prácticamente cualquier reacción. El ejemplo ( PageIndex {2} ) y su ejercicio correspondiente ilustran cómo podemos usar potenciales celulares medidos para calcular potenciales estándar para parejas redox.
Un positivo (E ° _ {cell} ) significa que la reacción ocurrirá espontáneamente como está escrito. Un (E ° _ {cell} ) negativo significa que la reacción procederá espontáneamente en la dirección opuesta.
Reference Electrodes and Measuring Concentrations
When using a galvanic cell to measure the concentration of a substance, we are generally interested in the potential of only one of the electrodes of the cell, the so-called indicator electrode , whose potential is related to the concentration of the substance being measured. To ensure that any change in the measured potential of the cell is due to only the substance being analyzed, the potential of the other electrode, the reference electrode , must be constant. You are already familiar with one example of a reference electrode: the SHE. The potential of a reference electrode must be unaffected by the properties of the solution, and if possible, it should be physically isolated from the solution of interest. To measure the potential of a solution, we select a reference electrode and an appropriate indicator electrode. Whether reduction or oxidation of the substance being analyzed occurs depends on the potential of the half-reaction for the substance of interest (the sample) and the potential of the reference electrode.
The potential of any reference electrode should not be affected by the properties of the solution to be analyzed, and it should also be physically isolated.
There are many possible choices of reference electrode other than the SHE. The SHE requires a constant flow of highly flammable hydrogen gas, which makes it inconvenient to use. Consequently, two other electrodes are commonly chosen as reference electrodes. One is the silver–silver chloride electrode , which consists of a silver wire coated with a very thin layer of AgCl that is dipped into a chloride ion solution with a fixed concentration. The cell diagram and reduction half-reaction are as follows:
[Cl^−_{(aq)}∣AgCl_{(s)}∣Ag_{(s)} label{20.4.36}]
[AgCl_{(s)}+e^− rightarrow Ag_{(s)} + Cl^−_{(aq)}]
If a saturated solution of KCl is used as the chloride solution, the potential of the silver–silver chloride electrode is 0.197 V versus the SHE. That is, 0.197 V must be subtracted from the measured value to obtain the standard electrode potential measured against the SHE.
A second common reference electrode is the saturated calomel electrode (SCE) , which has the same general form as the silver–silver chloride electrode. The SCE consists of a platinum wire inserted into a moist paste of liquid mercury (Hg 2 Cl 2 ; called calomel in the old chemical literature) and KCl. This interior cell is surrounded by an aqueous KCl solution, which acts as a salt bridge between the interior cell and the exterior solution (part (a) in Figure (PageIndex{5}). Although it sounds and looks complex, this cell is actually easy to prepare and maintain, and its potential is highly reproducible. The SCE cell diagram and corresponding half-reaction are as follows:
[Pt_{(s)} ∣ Hg_2Cl_{2(s)}∣KCl_{(aq, sat)} label{20.4.37}]
[Hg_2Cl_{2(s)} + 2e^− rightarrow 2Hg_{(l)} + 2Cl^−{(aq)} label{20.4.38}]
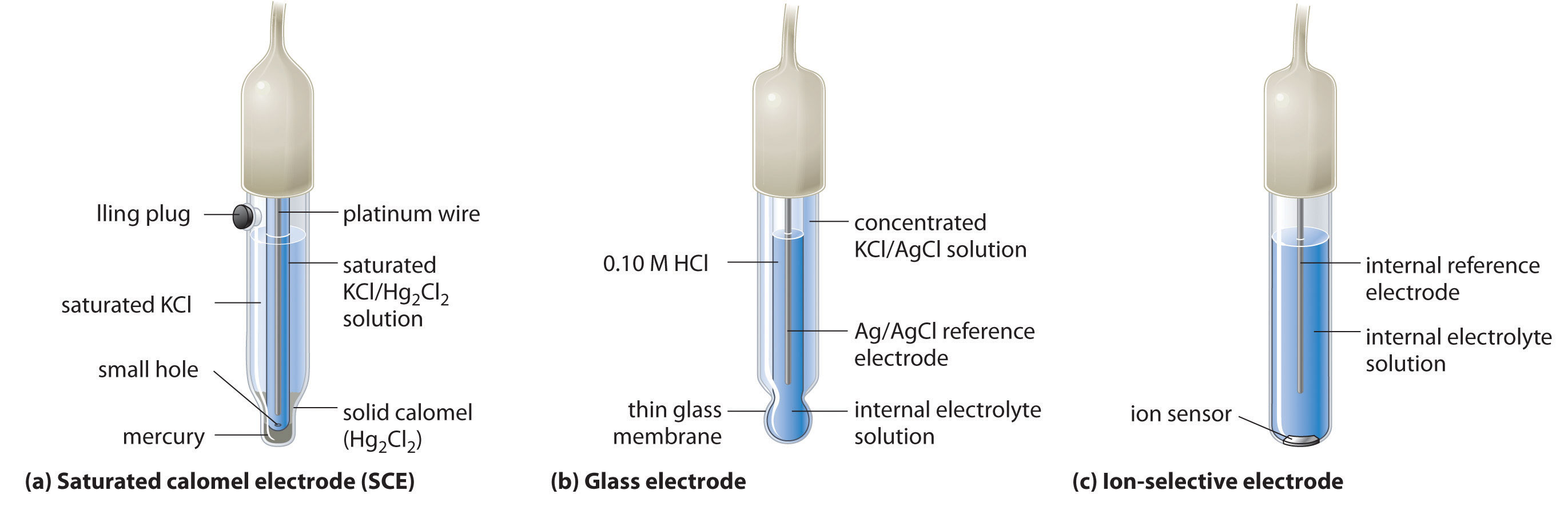
At 25°C, the potential of the SCE is 0.2415 V versus the SHE, which means that 0.2415 V must be subtracted from the potential versus an SCE to obtain the standard electrode potential.
One of the most common uses of electrochemistry is to measure the H + ion concentration of a solution. A glass electrode is generally used for this purpose, in which an internal Ag/AgCl electrode is immersed in a 0.10 M HCl solution that is separated from the solution by a very thin glass membrane (part (b) in Figure (PageIndex{5}). The glass membrane absorbs protons, which affects the measured potential. The extent of the adsorption on the inner side is fixed because [H + ] is fixed inside the electrode, but the adsorption of protons on the outer surface depends on the pH of the solution. The potential of the glass electrode depends on [H + ] as follows (recall that pH = −log[H + ]:
[E_{glass} = E′ + (0.0591; V times log[H^+]) = E′ − 0.0591; V times pH label{20.4.39}]
The voltage E′ is a constant that depends on the exact construction of the electrode. Although it can be measured, in practice, a glass electrode is calibrated; that is, it is inserted into a solution of known pH, and the display on the pH meter is adjusted to the known value. Once the electrode is properly calibrated, it can be placed in a solution and used to determine an unknown pH.
Ion-selective electrodes are used to measure the concentration of a particular species in solution; they are designed so that their potential depends on only the concentration of the desired species (part (c) in Figure (PageIndex{5})). These electrodes usually contain an internal reference electrode that is connected by a solution of an electrolyte to a crystalline inorganic material or a membrane, which acts as the sensor. For example, one type of ion-selective electrode uses a single crystal of Eu-doped (LaF_3) as the inorganic material. When fluoride ions in solution diffuse to the surface of the solid, the potential of the electrode changes, resulting in a so-called fluoride electrode. Similar electrodes are used to measure the concentrations of other species in solution. Some of the species whose concentrations can be determined in aqueous solution using ion-selective electrodes and similar devices are listed in Table (PageIndex{1}).
| Species | Type of Sample |
|---|---|
| H + | laboratory samples, blood, soil, and ground and surface water |
| NH 3 /NH 4 + | wastewater and runoff water |
| K + | blood, wine, and soil |
| CO 2 /HCO 3 − | blood and groundwater |
| F − | groundwater, drinking water, and soil |
| Br − | grains and plant extracts |
| I − | milk and pharmaceuticals |
| NO 3 − | groundwater, drinking water, soil, and fertilizer |
Summary
Redox reactions can be balanced using the half-reaction method. The standard cell potential is a measure of the driving force for the reaction. (E°_{cell} = E°_{cathode} − E°_{anode} ] The flow of electrons in an electrochemical cell depends on the identity of the reacting substances, the difference in the potential energy of their valence electrons, and their concentrations. The potential of the cell under standard conditions (1 M for solutions, 1 atm for gases, pure solids or liquids for other substances) and at a fixed temperature (25°C) is called the standard cell potential (E° cell ). Only the difference between the potentials of two electrodes can be measured. By convention, all tabulated values of standard electrode potentials are listed as standard reduction potentials. The overall cell potential is the reduction potential of the reductive half-reaction minus the reduction potential of the oxidative half-reaction (E° cell = E° cathode − E° anode ). The potential of the standard hydrogen electrode (SHE) is defined as 0 V under standard conditions. The potential of a half-reaction measured against the SHE under standard conditions is called its standard electrode potential. The standard cell potential is a measure of the driving force for a given redox reaction. All E° values are independent of the stoichiometric coefficients for the half-reaction. Redox reactions can be balanced using the half-reaction method, in which the overall redox reaction is divided into an oxidation half-reaction and a reduction half-reaction, each balanced for mass and charge. The half-reactions selected from tabulated lists must exactly reflect reaction conditions. In an alternative method, the atoms in each half-reaction are balanced, and then the charges are balanced. Whenever a half-reaction is reversed, the sign of E° corresponding to that reaction must also be reversed. If (E°_{cell}) is positive, the reaction will occur spontaneously under standard conditions. If (E°_{cell}) is negative, then the reaction is not spontaneous under standard conditions, although it will proceed spontaneously in the opposite direction. The potential of an indicator electrode is related to the concentration of the substance being measured, whereas the potential of the reference electrode is held constant. Whether reduction or oxidation occurs depends on the potential of the sample versus the potential of the reference electrode. In addition to the SHE, other reference electrodes are the silver–silver chloride electrode; the saturated calomel electrode (SCE); the glass electrode, which is commonly used to measure pH; and ion-selective electrodes, which depend on the concentration of a single ionic species in solution. Differences in potential between the SHE and other reference electrodes must be included when calculating values for E°.